Type I topoisomerase - Type I topoisomerase
| DNA topoisomerase I, N-terminal (ikke-katalytisk), viral | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 aminoterminal 9kda-domene for vaccinia-virus dna topoisomerase i rester 1-77, eksperimentell elektrontetthet for rester 1-77
| |||||||||
| Identifikatorer | |||||||||
| Symbol | VirDNA-topo-I_N | ||||||||
| Pfam | PF09266 | ||||||||
| InterPro | IPR015346 | ||||||||
| SCOP2 | 1vcc / SCOPe / SUPFAM | ||||||||
| |||||||||
I molekylærbiologi Type I topoisomeraser er enzymer som skjærer ett av de to tråder av dobbelttrådet DNA, slappe av strengen, og reanneal tråden. De er videre delt inn i to strukturelt og mekanistisk distinkte topoisomeraser: type IA og type IB.
- Type IA topoisomeraser endrer bindingsnummeret til en sirkulær DNA -streng med enheter på strengt 1.
- Type isopoisomeraser endrer koblingstallet med multipler av 1 (n).
Historisk sett omtales type IA topoisomeraser som prokaryote topo I, mens type IB topoisomeraser omtales som eukaryote topoisomerase. Dette skillet gjelder imidlertid ikke lenger ettersom topoisomeraser av type IA og type IB finnes på alle livsområder.
Funksjonelt utfører disse underklassene svært spesialiserte funksjoner. Prokaryotisk topoisomerase I (topo IA) kan bare slappe av negativt supercoiled DNA, mens eukaryot topoisomerase I (topo IB) kan introdusere positive supercoils, skille DNA fra datterkromosomer etter DNA -replikasjon og slappe av DNA.
Funksjon
Disse enzymene har flere funksjoner: å fjerne DNA -supercoils under transkripsjon og DNA -replikasjon ; for brudd på strengen under rekombinasjon ; for kromosomkondensasjon ; og for å fjerne sammenflettet DNA under mitose .
Struktur
Dette domenet forutsetter en beta (2) -alfa-beta-alfa-beta (2) fold, med en venstrehendt crossover mellom delene beta2 og beta3. Den har en fire kryss-krysset beta-tråder omgitt av fire alfa-helixer som er arrangert i en Rossmann-fold
Mekanismer
Type I topoisomeraser er ATP -uavhengige enzymer (unntatt reverse gyrase ), og kan deles opp i henhold til deres struktur og reaksjonsmekanismer: type IA (bakteriell og archaeal topoisomerase I, topoisomerase III og reverse gyrase) og type IB (eukaryot topoisomerase I og topoisomerase V). Disse enzymene er først og fremst ansvarlige for å slappe av positivt og/eller negativt supercoiled DNA, bortsett fra reverse gyrase, som kan introdusere positive supercoils i DNA.
DNA- topoisomeraser regulerer antall topologiske koblinger mellom to DNA-tråder (dvs. endrer antall superheliske svinger) ved å katalysere forbigående enkelt- eller dobbeltstrengede brudd, krysse trådene gjennom hverandre og deretter forsegle bruddene på nytt.
Klasser
DNA-topoisomeraser er delt inn i to klasser: type I- enzymer ( EC ; topoisomeraser I, III og V) bryter enkeltstrenget DNA, og type II-enzymer ( EC ; topoisomeraser II, IV og VI) bryter dobbeltstrenget DNA.
Type IA topoisomeraser
Introduksjon
Type IA topoisomeraser, som historisk sies å finnes i prokaryoter, skaper et enkelt brudd i DNA og passerer en andre streng eller dupleks gjennom bruddet. Denne strengpassasjemekanismen deler flere funksjoner med type IIA topoisomeraser. De danner begge et 5 'fosfotyrosin -mellomprodukt, og krever et toverdig metallion for å utføre arbeidet. I motsetning til topoisomeraser av type II , bruker ikke topoisomeraser av type IA energi til å utføre arbeidet sitt (med det bemerkelsesverdige unntaket for omvendt gyrase, se nedenfor).
Struktur
Type IA topoisomeraser har flere domener, ofte nummer domene 1-4. Domenet I inneholder et Toprim-domene (en Rossman-fold kjent for å koordinere magnesiumioner), domene IV og domene III består hver av et helix-turn-helix (HTH) domene; den katalytiske tyrosinen ligger på HTH for domene III. Domene II er en fleksibel bro mellom domenene III og IV. Strukturen av type IA topoisomerase ligner en lås, med domener I, III og IV liggende på bunnen av strukturen. Strukturen til topo III (se nedenfor) bundet til enkeltstrenget DNA (pdb id = 1I7D) viser hvordan HTH- og Toprim-domenet er koordinert om DNA.
Type IA topoisomerase varianter
Det er flere varianter av topoisomeraser av type IA, forskjellige med vedlegg festet til hovedkjernen (noen ganger referert til som "topo-fold"). Medlemmer av denne underklassen inkluderer topo I, topo III (som inneholder ytterligere sinkbindende motiver) og omvendt gyrase. Omvendt gyrase er spesielt interessant fordi et ATPase-domene, som ligner det helikaselignende domenet til Rho-transkripsjonsfaktoren, er festet (strukturen til omvendt gyrase ble løst av Rodriguez og Stock, EMBO J 2002). Enzymet bruker hydrolysen av ATP for å introdusere positive supercoils og overvind DNA, en funksjon som er attraktiv i hypertermofiler, der det er kjent at omvendt gyrase eksisterer. Rodriguez og Stock har gjort ytterligere arbeid for å identifisere en "lås" som er involvert i å kommunisere hydrolysen av ATP til introduksjonen av positive supercoils.
Topo III-varianten er også veldig interessant fordi den har sinkbindende motiver som antas å binde enkeltstrenget DNA. Topo III har blitt identifisert som assosiert med BLM (for Bloom Syndrome) helikase under rekombinasjon.
Mekanisme
Type IA topoisomeraser opererer gjennom en strengpassasjemekanisme, ved hjelp av en enkelt port (i motsetning til type II topoisomeraser). Først binder enkelstrenget DNA domene III og I. Det katalytiske tyrosinet klyver DNA-ryggraden og danner et forbigående 5 'fosfotyrosin-mellomprodukt. Bruddet separeres deretter ved å bruke domene II som et hengsel, og en andre dupleks eller DNA -streng blir ført gjennom. Domenet III og jeg lukker og DNA blir annealet på nytt.
Type IB topoisomeraser
Introduksjon
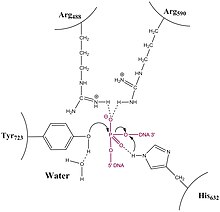
I motsetning til type IA topoisomeraser, løser type 1B Topoisomerase problemet med overviklet og underviklet (også referert til som positivt eller negativt supercoiled) DNA gjennom en hindret roterende mekanisme. Krystallstrukturer, biokjemi og enkeltmolekylforsøk har bidratt til en generell mekanisme. Enzymet brytes først rundt DNA og danner et enkelt, 3 'fosfotyrosin -mellomprodukt. 5'-enden er deretter fri til å rotere, vri den rundt den andre tråden, for å slappe av DNA til topoisomerasen re-ligerer de ødelagte trådene.
Struktur
Strukturen til topo IB bundet til DNA er løst (pdb id = 1A36). Topo IB består av en NTD, en kapsling, en katalytisk lap og et C-terminal domene. Cappelappen og katalytisk lap vikles rundt DNA.
Mekanisme
Avslapning er ikke en aktiv prosess, og energi (i form av ATP ) blir ikke brukt under trinnene for nicking eller ligering; dette er fordi reaksjonen mellom tyrosinresten på det aktive stedet av enzymet med fosfodiester -DNA -ryggraden ganske enkelt erstatter en fosfomonoesterbinding med en annen. Topoisomerasen bruker heller ikke ATP under utrulling av DNA; snarere, dreiemomentet som er tilstede i DNA -en driver avviklingen og fortsetter i gjennomsnitt energisk nedoverbakke. Nylige eksperimenter med enkeltmolekyl har bekreftet hva bulk-plasmid-avslapningseksperimenter har foreslått tidligere, som er at opprulling av DNA er dreiemomentdrevet og fortsetter til religering skjer. Ingen data tyder på at Topo IB "kontrollerer" svingningen i den grad den har en mekanisme på plass som utløser religiøsitet etter at et bestemt antall supercoils er fjernet. Tvert imot antyder enkeltmolekylære eksperimenter at religering er en tilfeldig prosess og har en viss sannsynlighet for å forekomme hver gang den svingbare 5'-OH-enden kommer i umiddelbar nærhet av festingsstedet til den enzymkoblede 3'-enden.
Topoisomeraser av type IB ble opprinnelig identifisert i eukaryoter og i virus. Viral topo I er unik fordi den binder DNA på en sekvens-spesifikk måte.
Se artikkelen TOP1 for ytterligere detaljer om denne godt studerte topoisomerasen av type 1B.
Type IC topoisomeraser
En tredje type topoisomerase I ble identifisert, topo V, i arkeonet Methanopyrus kandleri . Topo V er grunnleggeren, og så langt det eneste medlemmet, av typen IC topoisomerase, selv om noen forfattere antyder at det kan ha viral opprinnelse. Krystallstrukturen til topo V ble løst. Type IC topoisomeraser fungerer gjennom en kontrollert roterende mekanisme, omtrent som type IB topoisomeraser (pdb ID = 2CSB og 2CSD ), men brettet er unikt.
Mellomprodukter
Alle topoisomeraser danner et fosfotyrosin -mellomprodukt mellom det katalytiske tyrosinet til enzymet og scissile fosforylen i DNA -ryggraden .
- Type IA topoisomeraser danner en kovalent kobling mellom katalytisk tyrosin og 5'-fosforyl.
- Enzymer av type IB danner et kovalent 3'-fosfotyrosin-mellomprodukt.
- Type IC-topoisomeraser danner et kovalent 3'-fosfotyrosin-mellomprodukt.
Dette mellomproduktet er isoenergetisk, noe som betyr at fremspaltningsreaksjonen og tilbakestående religionsreaksjonen begge er energisk like. Som sådan er ingen ekstern energikilde nødvendig for å utføre denne reaksjonen.
Inhibering
Siden topoisomeraser genererer brudd i DNA, er de mål for småmolekylære hemmere som hemmer enzymet. Type 1 topoisomerase hemmes av irinotecan , topotecan , hexylresorcinol og camptothecin .
Det humane topoisomerase type IB-enzym danner et kovalent 3'-fosfotyrosin-mellomprodukt, topoisomerase 1-spaltningskomplekset (Top1cc). Den aktive irinotekanmetabolitten, SN-38 , virker ved å fange (lage et ternært kompleks med) en delmengde av Top1cc, de med en guanin +1 i DNA-sekvensen. Ett irinotekan-avledet SN-38-molekyl stabler mot baseparene som flankerer det topoisomerase-induserte spaltingsstedet og forgifter (inaktiverer) topoisomerase 1-enzymet.
Ved bakteriofag (fag) T4 infeksjon av dens bakteriell vert, Escherichia coli , fagen genom angir en genproduktet (gp55.2) som hemmer den bakterielle topoisomerase I. Gp55.2 binder DNA og spesifikt blokkerer den avslapning av negativt superkveilet DNA ved topoisomerase I. Denne inhiberingen ser ut til å være en tilpasning til å subtilt modulere vertstopoisomerase I -aktivitet under infeksjon for å sikre optimal fagutbytte.
Syntetisk dødelighet
Syntetisk dødelighet oppstår når en kombinasjon av mangler i uttrykket av to eller flere gener fører til celledød, mens en mangel på bare ett av disse genene ikke gjør det. Manglene kan oppstå gjennom mutasjon, epigenetisk endring eller ved inhibering av et gen uttrykk.
Topoisomerase 1 -inhibering er syntetisk dødelig med mangel på ekspresjon av visse DNA -reparasjonsgener. Hos menneskelige pasienter inkluderer de mangelfulle DNA -reparasjonsgenene WRN og MRE11 . I prekliniske studier relatert til kreft inkluderer de mangelfulle DNA-reparasjonsgenene ATM og NDRG1 .
Autoantistoffer
Autoantistoffer rettet mot type I-topoisomerase kalles anti-SCL-70-antistoffer , som er oppkalt etter foreningen med SCL eroderma og 70 kD ekstraherbare immunoreaktivt fragment som kan oppnås fra den ellers større (100-105 kD) mål-topoisomerase- antigen (kalt SCL -70 Antigen) av antistoffene.
Referanser
Eksterne linker
- DNA+Topoisomeraser,+Type+I ved US National Library of Medicine Medical Subject Headings (MeSH)