Friedel – Crafts reaksjon - Friedel–Crafts reaction
| Friedel-Crafts reaksjon | |
|---|---|
| Oppkalt etter |
Charles Friedel James Crafts |
| Reaksjonstype | Koblingsreaksjon |
| Identifikatorer | |
| RSC ontologi ID | RXNO: 0000369 |
De Friedel-Crafts-reaksjoner er et sett av reaksjoner utviklet av Charles Friedel og James Crafts i 1877 for å feste substituenter til en aromatisk ring . Friedel – Crafts -reaksjoner er av to hovedtyper: alkyleringsreaksjoner og acyleringsreaksjoner . Begge fortsetter med elektrofil aromatisk substitusjon .
Friedel – Crafts alkylering
| Friedel-Crafts alkylering | |
|---|---|
| Oppkalt etter |
Charles Friedel James Crafts |
| Reaksjonstype | Koblingsreaksjon |
| Identifikatorer | |
| Organisk kjemiportal | friedel-crafts-alkylation |
| RSC ontologi ID | RXNO: 0000046 |
Friedel - Crafts alkylering innebærer alkylering av en aromatisk ring med et alkylhalogenid ved bruk av en sterk Lewis -syre , for eksempel aluminiumklorid , jernklorid eller annet MX n -reagens, som katalysator . Den generelle mekanismen for tertiære alkylhalogenider er vist nedenfor.
For primære (og muligens sekundære) alkylhalogenider, er et karbokasjonslignende kompleks med Lewis-syren, [R (+) --- (X --- MX n ) (-) ] mer sannsynlig å være involvert enn en gratis karbonisering.
Denne reaksjonen lider av den ulempen at produktet er mer nukleofilt enn reaktanten fordi alkylgrupper er aktivatorer for Friedel -Crafts -reaksjonen . Følgelig kan overalkylering oppstå. Sterisk hindring kan utnyttes for å begrense antall alkyleringer, som i t -butylering av 1,4 -dimetoksybenzen.
Videre er reaksjonen bare nyttig for primære alkylhalogenider i intramolekylær forstand når en 5- eller 6-leddet ring dannes. For det intermolekylære tilfellet er reaksjonen begrenset til tertiære alkyleringsmidler, noen sekundære alkyleringsmidler (de som karbokaliseringen er degenerert for), eller alkyleringsmidler som gir stabiliserte karbokasjoner (f.eks. Benzyliske eller allyliske). I tilfelle av primære alkylhalogenider, den karbokation-liknende kompleks (R (+) --- X --- Al (-) Cl 3 ) vil gjennomgå en karbokation omleiringsreaksjon for å gi nesten utelukkende de rearrangerte produkter som utledes fra en sekundær eller tertiær karbokasjon.
Alkyleringer er ikke begrenset til alkylhalogenider: Friedel-Crafts-reaksjoner er mulig med noen karbokationiske mellomprodukt, slik som de som er avledet fra alkener og en protisk syre , Lewis-syre , enones og epoksider . Et eksempel er syntesen av neofylklorid fra benzen og metallylklorid:
- H 2 C = C (CH 3 ) CH 2 Cl + C 6 H 6 → C 6 H 5 C (CH 3 ) 2 CH 2 Cl
I en studie er elektrofilen et bromoniumion avledet fra et alken og NBS :
I denne reaksjonen antas det at samarium (III) triflat aktiverer NBS -halogendonoren i haloniumiondannelse.
Friedel - Crafts dealkylation
Det er antatt at Friedel – Crafts alkylering er reversibel . I en retro-Friedel-Crafts reaksjon eller Friedel-Crafts dealkylering fjernes alkylgrupper i nærvær av protoner eller annen Lewis-syre .
For eksempel, ved flere tilsetninger av etylbromid til benzen , forventes orto- og para -substitusjon etter det første monosubstitusjonstrinnet fordi en alkylgruppe er en aktiverende gruppe . Imidlertid er selve reaksjonsproduktet 1,3,5-trietylbenzen med alle alkylgrupper som en meta -substituent . Termodynamisk reaksjonskontroll sørger for at termodynamisk favorisert metasubstitusjon med sterisk hindring minimert tar prevalens over mindre gunstig orto og para -substitusjon ved kjemisk ekvilibrering . Det endelige reaksjonsproduktet er dermed resultatet av en rekke alkyleringer og dealkyleringer.
Friedel – Crafts acylering
| Friedel-Crafts acylering | |
|---|---|
| Oppkalt etter |
Charles Friedel James Crafts |
| Reaksjonstype | Koblingsreaksjon |
| Identifikatorer | |
| Organisk kjemiportal | friedel-crafts-acylation |
| RSC ontologi ID | RXNO: 0000045 |
Friedel – Crafts acylering innebærer acylering av aromatiske ringer. Typiske acyleringsmidler er acylklorider . Typiske Lewis -syrekatalysatorer er syrer og aluminiumtriklorid. Imidlertid, fordi produktet keton danner et ganske stabilt kompleks med Lewis-syrer slik som AlCl ^ 3 , en støkiometrisk mengde eller mer av de "katalysator" skal generelt anvendes, i motsetning til tilfellet av Friedel-Crafts-alkylering, hvor katalysatoren er i stadig regenerert. Friedel – Crafts acylering er også mulig med syreanhydrider . Reaksjonsbetingelsene ligner på Friedel – Crafts alkylering. Denne reaksjonen har flere fordeler i forhold til alkyleringsreaksjonen. På grunn av den elektronuttrekkende effekten av karbonylgruppen , er ketonproduktet alltid mindre reaktivt enn det opprinnelige molekylet, så flere acyleringer forekommer ikke. Dessuten er det ingen karbokation rearrangementer, som acylium ion er stabilisert ved hjelp av en resonansstruktur hvor den positive ladning er på oksygen.
Levedyktigheten til Friedel – Crafts -acyleringen avhenger av stabiliteten til acylkloridreagenset. Formylklorid er for eksempel for ustabilt til å isoleres. Således krever syntese av benzaldehyd gjennom Friedel - Crafts -banen at formylklorid syntetiseres in situ . Dette oppnås ved Gattermann-Koch-reaksjonen , oppnådd ved behandling av benzen med karbonmonoksid og hydrogenklorid under høyt trykk, katalysert av en blanding av aluminiumklorid og kobberklorid .
Reaksjonsmekanisme
Reaksjonen fortsetter gjennom generering av et acylium -senter. Reaksjonen fullføres ved deprotonering av areniumionet med AlCl 4 - , regenerering av AlCl 3 -katalysatoren. I motsetning til den virkelig katalytiske alkyleringsreaksjonen, er det dannede keton imidlertid en moderat Lewis -base, som danner et kompleks med det sterke Lewis -syre -aluminiumtrikloridet. Dannelsen av dette komplekset er vanligvis irreversibel under reaksjonsbetingelser. Således, en støkiometrisk mengde AlCl 3 er nødvendig. Komplekset ødelegges ved vandig opparbeiding for å gi ønsket keton. For eksempel, den klassiske syntese av deoxybenzoin samtaler til 1,1 ekvivalenter av AlCl 3 i forhold til den begrensende reagens, fenylacetylklorid. I visse tilfeller, vanligvis når benzenringen aktiveres, kan Friedel-Crafts acylering også utføres med katalytiske mengder av en mildere Lewis-syre (f.eks. Zn (II) salter) eller en Brønsted-syrekatalysator ved bruk av anhydridet eller til og med karboksylsyren seg selv som acyleringsmiddel.
Hvis ønskelig, kan det resulterende keton deretter reduseres til den tilsvarende alkansubstituenten ved enten Wolff - Kishner reduksjon eller Clemmensen reduksjon . Nettoresultatet er det samme som Friedel – Crafts alkylering bortsett fra at omorganisering ikke er mulig.
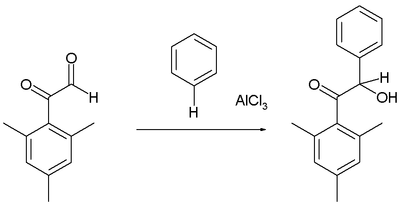
Friedel – Crafts hydroksyalkylering
Arenene reagerer med visse aldehyder og ketoner for å danne hydroksyalkylerte produkter, for eksempel i reaksjonen av mesitylderivatet av glyoksal med benzen:
Som vanlig er aldehydgruppen mer reaktiv elektrofil enn fenonet .
Omfang og variasjoner
Denne reaksjonen er relatert til flere klassiske navngitte reaksjoner:
- Det acylerte reaksjonsproduktet kan omdannes til det alkylerte produktet via en Clemmensen -reduksjon .
- Den Gattermann-Koch reaksjon kan brukes for å syntetisere benzaldehyd fra benzen.
- Den Gatterman reaksjonen beskriver aren-reaksjoner med blåsyre.
- Den Houben-Hoesch-reaksjon beskriver aren-reaksjoner med nitriler.
- En reaksjonsmodifikasjon med en aromatisk fenylester som reaktant kalles Fries -omorganiseringen .
- I Scholl -reaksjonen kobler to arenaer seg direkte (noen ganger kalt Friedel - Crafts arylation ).
- I sink-Suhl reaksjon p -kresol blir alkylert til en cyclohexadienone med tetraklormetan.
- I Blanc -klormetyleringen tilsettes en klormetylgruppe til en aren med formaldehyd, saltsyre og sinkklorid.
- Den Bogert-Cook syntese (1933) omfatter dehydrering og isomerisering av 1-β-phenylethylcyclohexanol til oktahydro derivat av fenantren
- Den Darzens-Nenitzescu syntese av ketoner (1910, 1936) omfatter acylering av cykloheksen med acetylklorid for å methylcyclohexenylketone.
- I den relaterte Nenitzescu -reduktive acyleringen (1936) tilsettes et mettet hydrokarbon som gjør det til en reduktiv acylering til metylcykloheksylketon
- Den NENCKI reaksjon (1881) er den ring acetylering av fenoler med syrer i nærvær av sinkklorid.
- I en grønn kjemi variasjon aluminiumklorid er erstattet av grafitt i en alkylering av p -xylen med 2-brombutan . Denne variasjonen vil ikke fungere med primære halogenider, der det er utledet mindre karbokasjonsinvolvering.
Fargestoffer
Friedel – Crafts reaksjoner har blitt brukt i syntesen av flere triarylmetan og xantene fargestoffer . Eksempler er syntese av tymolftalein (en pH -indikator) fra to ekvivalenter tymol og ftalinsyreanhydrid :
En reaksjon av ftalsyreanhydrid med resorcinol i nærvær av sinkklorid gir fluoroforen fluorescein . Erstatning av resorcinol med N, N-dietylaminofenol i denne reaksjonen gir rhodamin B :
Haworth reaksjoner
Den Haworth reaksjon er en klassisk metode for syntese av 1-tetralon . I denne reaksjonen reageres benzen med ravsyreanhydrid , mellomproduktet reduseres og en andre FC -acylering finner sted med tilsetning av syre.
I en beslektet reaksjon syntetiseres fenantren fra naftalen og ravsyreanhydrid i en rekke trinn som begynner med FC -acylering.
Friedel – Crafts test for aromatiske hydrokarboner
Reaksjon av kloroform med aromatiske forbindelser ved bruk av en aluminiumkloridkatalysator gir triarylmetaner, som ofte er fargerike, som tilfellet er i triarylmetanfargestoffer. Dette er en benketest for aromatiske forbindelser.
Se også
- Etylenoksyd
- Friedel -familien , en rik slekt av franske forskere
- Hydrodealkylering
- Transalkylering
Referanser
- ^ Friedel, C .; Crafts, JM (1877) "Sur une nouvelle méthode générale de synthèse d'hydrocarbures, d'acétones, etc.," Compt. Rend. , 84 : 1392 & 1450 .
- ^ Pris, CC (1946). "Alkylering av aromatiske forbindelser ved Friedel-Crafts-metoden". Org. Reager . 3 : 1. doi : 10.1002/0471264180.or003.01 . ISBN 0471264180.
- ^ Groves, JK (1972). "Friedel - Crafts acylering av alkener". Chem. Soc. Rev. 1 : 73. doi : 10.1039/cs9720100073 .
- ^ Eyley, SC (1991). "Den alifatiske Friedel - Crafts -reaksjonen". Kompr. Org. Synth . 2 : 707–731. doi : 10.1016/B978-0-08-052349-1.00045-7 . ISBN 978-0-08-052349-1.
- ^ Heaney, H. (1991). "Den bimolekylære aromatiske Friedel - Crafts -reaksjonen". Kompr. Org. Synth . 2 : 733–752. doi : 10.1016/B978-0-08-052349-1.00046-9 . ISBN 978-0-08-052349-1.
- ^ Rueping, M .; Nachtsheim, BJ (2010). "En gjennomgang av ny utvikling i Friedel – Crafts alkylering - Fra grønn kjemi til asymmetrisk katalyse" . Beilstein J. Org. Chem . 6 (6): 6. doi : 10.3762/bjoc.6.6 . PMC 2870981 . PMID 20485588 .
- ^ a b Smith, Michael B .; March, Jerry (2007), Advanced Organic Chemistry: Reactions, Mechanisms, and Structure (6. utg.), New York: Wiley-Interscience, ISBN 978-0-471-72091-1
- ^ L., Williamson, Kenneth (4. januar 2016). Makroskala og mikroskala organiske eksperimenter . Masters, Katherine M. (syvende utg.). Boston, MA, USA. ISBN 9781305577190. OCLC 915490547 .
- ^ Smith, WT Jr.; Sellas, JT (1963). "Neophylklorid" . Organiske synteser .
- ^ Hajra, S .; Maji, B .; Bar, S. (2007). "Samarium Triflate-Catalyzed Halogen-Promoted Friedel-Crafts Alkylation with Alkenes". Org. Lett. 9 (15): 2783–2786. doi : 10.1021/ol070813t . PMID 17585769 .
- ^ Anslyn, E .; Wallace, KJ; Hanes, R .; Morey, J .; Kilway, KV; Siegel, J. (2005). "Fremstilling av 1,3,5-Tris (aminometyl) -2,4,6-trietylbenzen fra to allsidige 1,3,5-Tri (halosubstituerte) 2,4,6-trietylbenzen-derivater". Syntese . 2005 (12): 2080–2083. doi : 10.1055/s-2005-869963 .
- ^ Norman, Richard Oswald Chandler; Coxon, James Morriss (1993). Prinsipper for organisk syntese (3. utg.). London: Blackie Academic & Professional. ISBN 0751401269. OCLC 27813843 .
- ^ Somerville, LF; Allen, CFH (1933). "β-benzoylpropionsyre". Organiske synteser . 13 : 12. doi : 10.15227/orgsyn.013.0012 .
- ^ "Desoxybenzoin" . www.orgsyn.org . Hentet 26. januar 2019 .
- ^ Friedel-Crafts Acylation . Organic-chemistry.org. Hentet 2014-01-11.
- ^ Fuson, RC; Weinstock, HH; Ullyot, GE (1935). "En ny syntese av benzoiner. 2 ', 4', 6'-trimetylbenzoin". J. Am. Chem. Soc. 57 (10): 1803–1804. doi : 10.1021/ja01313a015 .
- ^ Clemmensen, E. (1913). "Reduksjon von Ketonen und Aldehyden zu den entsprechenden Kohlenwasserstoffen unter Anwendung von amalgamiertem Zink und Salzsäure" . Chemische Berichte . 46 (2): 1837–1843. doi : 10.1002/cber.19130460292 .
- ^ Clemmensen, E. (1914). "Über eine allgemeine Methode zur Reduktion der Carbonylgruppe in Aldehyden und Ketonen zur Methylengruppe" . Chemische Berichte . 47 : 51–63. doi : 10.1002/cber.19140470108 .
- ^ Clemmensen, E. (1914). "Über eine allgemeine Methode zur Reduktion der Carbonylgruppe in Aldehyden und Ketonen zur Methylengruppe. (III. Mitteilung.)" . Chemische Berichte . 47 : 681–687. doi : 10.1002/cber.191404701107 .
- ^ Gattermann, L .; Koch, JA (1897). "Eine Synthese aromatischer Aldehyde" . Ber. 30 (2): 1622–1624. doi : 10.1002/cber.18970300288 .
- ^ L. Gattermann; W. Berchelmann (1898). "Syntese aromatischer Oxyaldehyde" . Berichte der Deutschen Chemischen Gesellschaft . 31 (2): 1765–1769. doi : 10.1002/cber.18980310281 .
- ^ Hoesch, Kurt (1915). "Eine neue Synthese aromatischer Ketone. I. Darstellung einiger Phenol-ketone" . Berichte der Deutschen Chemischen Gesellschaft . 48 (1): 1122–1133. doi : 10.1002/cber.191504801156 .
- ^ Houben, J. (1926). "Über die Kern-Kondensation von Phenolen und Phenol-äthern mit Nitrilen zu Phenol- und Phenol-äther-Ketimiden und -Ketonen (I.)". Berichte der Deutschen Chemischen Gesellschaft (A- og B -serien) . 59 (11): 2878–2891. doi : 10.1002/cber.19260591135 .
- ^ MB Smith, J mars. March's Advanced Organic Chemistry (Wiley, 2001) ( ISBN 0-471-58589-0 )
- ^ Grzybowski, M .; Skonieczny, K .; Butenschön, H .; Gryko, DT (2013). "Sammenligning av oksidativ aromatisk kopling og Scholl -reaksjonen". Angew. Chem. Int. Ed . 52 (38): 9900–9930. doi : 10.1002/anie.201210238 . PMID 23852649 .
- ^ Zincke, Th. ; Suhl. R. (1906). "Ueber die Einwirkung von Tetrachlorkohlenstoff und Aluminiumchlorid auf p -Kresol und p -Kresolderivate" . Chemische Berichte . 39 (4): 4148–4153. doi : 10.1002/cber.190603904115 .
-
^ Blanc, Gustave Louis (1923). Bulletin de la Société Chimique de France [4] . 33 : 313–319. Mangler eller er tom
|title=( hjelp ) - ^ G. Grassi og C. Maselli (1898) "Su alcuni derivati clorurati de trossimetilene" (Om noen klorerte derivater av 1,3,5-trioxan), Gazzetta Chimica Italiana , 28 (del 2): 477-500; se spesielt s. 495.
- ^ Denne reaksjonen med fosforpentoksid : Kamp, JVD; Mosettig, E. (1936). "Trans- og Cis-As-Octahydrophenanthrene". Journal of the American Chemical Society . 58 (6): 1062–1063. doi : 10.1021/ja01297a514 .
- ^ Nencki, M .; Sieber, N. (1881). "Ueber die Verbindungen der ein- und zweibasischen Fettsäuren mit Phenolen" . J. Prakt. Chem. (på tysk). 23 : 147–156. doi : 10.1002/prac.18810230111 .
- ^ Sereda, Grigoriy A .; Rajpara, Vikul B. (2007). "Et grønt alternativ til aluminiumkloridalkylering av xylen". J. Chem. Educ. 2007 (84): 692. Bibcode : 2007JChEd..84..692S . doi : 10.1021/ed084p692 .
- ^ McCullagh, James V .; Daggett, Kelly A. (2007). "Syntese av triarylmetan- og xanthenfargestoffer ved bruk av elektrofile aromatiske substitusjonsreaksjoner" . J. Chem. Educ. 84 (11): 1799. Bibcode : 2007JChEd..84.1799M . doi : 10.1021/ed084p1799 .
- ^ Haworth, Robert Downs (1932). "Synteser av alkylfenantrener. Del I. 1-, 2-, 3- og 4-metylfenantrener". J. Chem. Soc. : 1125. doi : 10.1039/JR9320001125 .
- ^ Li, Jie Jack (2003) Navnereaksjoner : En samling av detaljerte reaksjonsmekanismer , Springer, ISBN 3-540-40203-9 , s. 175.
- ^ John C. Gilbert., Stephen F. Martin. Brooks/Cole CENGAGE Learning, 2011. s 872. 25.10 Aromatiske hydrokarboner og arylhalogenider - Klassifiseringstest. ISBN 978-1-4390-4914-3
Friedel - Crafts -reaksjoner publisert på organiske synteser
- Alkyleringer:
- Difenylaceton, organiske synteser, Coll. Vol. 3, s. 343 (1955); Vol. 29, s. 38 (1949) Artikkellink .
- Reaksjon av p -xylen med klormetan til durene Organic Syntheses, Coll. Vol. 2, s. 248 (1943); Vol. 10, s. 32 (1930). Artikkellink
- Syntese av benzofenon fra benzen og tetraklormetan Organiske synteser, Coll. Vol. 1, s. 95 (1941); Vol. 8 poeng. 26 (1928). Artikkellink
- Acyleringer:
- Dibenzoylethylene Organic Syntheses, Coll. Vol. 3, s. 248 (1955); Vol. 20, s. 29 (1940) Artikkellink .
- reaksjon av acenaften pluss ravsyre Organic Syntheses, Coll. Vol. 3, s. 6 (1955); Vol. 20, s. 1 (1940). Artikkellink
- Desoxybenzoin Organic Syntheses, Coll. Vol. 2, s. 156 (1943); Vol. 12, s. 16 (1932). Artikkellink
- Acylering av en fenantrenforbindelse Organic Syntheses, Vol. 80, s. 227 Lenke
- Reaksjon av brombenzen med eddiksyreanhydrid Organic Syntheses, Coll. Vol. 1, s. 109 (1941); Vol. 5, s. 17 (1925). Artikkellink
- beta-metylantrakinon, organiske synteser, Coll. Vol. 1, s. 353 (1941); Vol. 4, s. 43 (1925). Artikkellink
- Benzoylering av ferrocene Organic Syntheses, Coll. Vol. 6, s. 625 (1988); Vol. 56, s. 28 (1977). Artikkellink