Vert -gjest kjemi - Host–guest chemistry
I supramolekylær kjemi , vert-gjest kjemi beskriver komplekser som er sammensatt av to eller flere molekyler eller ioner som holdes sammen i unike strukturelle forhold med andre enn de som er av full krefter kovalente bindinger . Vert-gjest-kjemi omfatter ideen om molekylær gjenkjenning og interaksjoner gjennom ikke-kovalent binding . Ikke-kovalent binding er kritisk for å opprettholde 3D-strukturen til store molekyler, for eksempel proteiner, og er involvert i mange biologiske prosesser der store molekyler binder seg spesifikt, men forbigående til hverandre.
Selv om ikke-kovalente interaksjoner grovt kan deles inn i de med mer elektrostatiske eller dispersive bidrag, er det få ofte nevnte typer ikke-kovalente interaksjoner: ionisk binding , hydrogenbinding , van der Waals-krefter og hydrofobe interaksjoner .


Oversikt
Vert -gjest -kjemi er en gren av supramolekylær kjemi der et vertsmolekyl danner en kjemisk forbindelse med et gjestemolekyl eller ion. De to komponentene i forbindelsen holdes sammen av ikke-kovalente krefter, oftest ved hydrogenbinding . Binding mellom vert og gjest er vanligvis svært spesifikk for de to delene det gjelder. Dannelsen av disse kompleksene er sentral for gjenstanden for molekylær gjenkjenning .
Det er en likevekt mellom den ubundne tilstanden, der vert og gjest er atskilt fra hverandre, og den bundne tilstanden, der det er et strukturelt definert vert -gjest -kompleks:
- H = "vert", G = "gjest", HG = "vert – gjestkompleks"
"Vert" -komponenten kan betraktes som det større molekylet, og den omfatter det mindre "gjesten" -molekylet. I biologiske systemer blir de analoge begrepene vert og gjest ofte referert til som henholdsvis enzym og substrat .
For å designe syntetiske systemer som utfører spesifikke funksjoner og oppgaver, er det veldig viktig å forstå termodynamikken for binding mellom vert og gjest. Kjemikere fokuserer på energiutveksling av forskjellige bindingsinteraksjoner og prøver å utvikle vitenskapelige eksperimenter for å kvantifisere den grunnleggende opprinnelsen til disse ikke-kovalente interaksjonene ved å benytte forskjellige teknikker som NMR-spektroskopi, UV/synlig spektroskopi og isotermisk titreringskalorimetri. Kvantitativ analyse av bindende konstante verdier gir nyttig termodynamisk informasjon.
Termodynamiske prinsipper for vert -gjest -interaksjoner
De termodynamiske fordelene med vert -gjest -kjemi stammer fra ideen om at det er en lavere generell Gibbs -fri energi på grunn av samspillet mellom verts- og gjestemolekyler. Kjemikere prøver uttømmende å måle energien og termodynamiske egenskapene til disse ikke-kovalente interaksjonene som finnes gjennom supramolekylær kjemi; og ved å gjøre det håper du å få ytterligere innsikt i det kombinatoriske resultatet av disse mange, små, ikke-kovalente kreftene som brukes til å generere en samlet effekt på den supramolekylære strukturen.
En assosiasjonskonstant , kan defineres ved uttrykket
hvor {HG} er den termodynamiske aktiviteten til komplekset ved likevekt. {H} representerer aktivitetene til verten og {G} aktiviteten til gjesten. Mengdene , og er de tilsvarende konsentrasjonene, og er en kvot av aktivitetskoeffisienter .
I praksis er likevektskonstanten vanligvis definert når det gjelder konsentrasjoner.
Når denne definisjonen brukes, antydes det at kvoten for aktivitetskoeffisienter har en numerisk verdi på en. Det fremgår da at likevektskonstanten, har den dimensjon 1 / konsentrasjon, men det kan ikke være sant ettersom standard Gibbs fri energi, er proporsjonal med logaritmen til K .
Dette tilsynelatende paradokset løses når dimensjonen av er definert som det gjensidige av dimensjonen til konsentrasjonskvoten. Implikasjonen er at den anses å ha en konstant verdi under alle relevante eksperimentelle forhold. Likevel er det vanlig praksis å feste en dimensjon, for eksempel millimol per liter eller mikromol per liter, til en verdi av K som er bestemt eksperimentelt.
En stor verdi indikerer at verts- og gjestmolekyler samhandler sterkt for å danne vert -gjest -komplekset.
Bestemmelse av bindende konstante verdier
Enkel vert -gjest -kompleks
Når verts- og gjestemolekylene kombineres for å danne et enkelt kompleks, er likevekten representert som
og likevektskonstanten, K, er definert som
der [X] angir konsentrasjonen av en kjemisk art X (alle aktivitetskoeffisienter antas å ha en numerisk verdi på 1). Massebalanse-ligningene, på et hvilket som helst datapunkt,
hvor og representerer de totale konsentrasjonene, av vert og gjest, kan reduseres til en enkelt kvadratisk ligning i, si, [G] og så kan løses analytisk for en gitt verdi av K. Konsentrasjonene [H] og [HG] kan deretter avledet.
Det neste trinnet i beregningen er å beregne verdien ,, av en mengde som tilsvarer mengden observert . Deretter kan en sum av firkanter, U, over alle datapunkter, np, defineres som
og dette kan minimeres med hensyn til stabilitetskonstantverdien, K, og en parameter slik det kjemiske skiftet til arten HG (nmr -data) eller dets molare absorberingsevne (uv/vis -data). Minimeringen kan utføres i et regnearkprogram som EXCEL ved å bruke det innebygde SOLVER-verktøyet.
Denne fremgangsmåten bør bare brukes når det er sikkert at 1: 1 -adduktet er den eneste komplekse arten som dannes. En enkel kontroll av gyldigheten av denne påstanden er at residualene skal vise en tilfeldig fordeling ; ellers bør dannelsen av en andre art vurderes ved å bruke metodene i den følgende seksjonen.
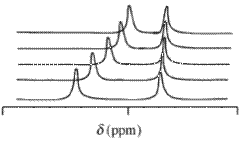
Kjernemagnetisk resonans (NMR) data
Med kjernemagnetisk resonans (NMR) spektra er de observerte kjemiske skift verdi, δ , som følge av et gitt atom som befinner seg i en reagensmolekyl og ett eller flere komplekser av dette reagens, vil være den konsentrasjon-vektede gjennomsnittet av alle forskyvninger av disse kjemiske forbindelser. Kjemisk utveksling antas å være rask på NMR-tidsskalaen. vilkår for molfraksjoner ,
er det kjemiske skiftet til den i kjemiske arten som inneholder kjernen og er konsentrasjonen / mol fraksjonen ( c er en konsentrasjon / mol dm −3 ) av den arten. Dette uttrykket har samme matematiske form som Beers lov . Kjemiske skiftverdier kan oppnås for mer enn en kjerne på en analog måte, slik at absorbansen kan måles ved mer enn én bølgelengde. Typiske isotoper som kan brukes i denne sammenhengen er 1 H, 13 C og 31 P. Det er vanlig å bruke et deuterert løsningsmiddel når man måler 1 H kjemiske skiftverdier.
Absorbansdata
Det antas at absorbansen til hver art er proporsjonal med konsentrasjonen av den arten, i henhold til Beer - Lambert -loven .
der λ er en bølgelengde, er den optiske banelengden til kyvetten som inneholder løsningen av N -forbindelsene ( kromoforer ), er molarabsorbansen (også kjent som utryddelseskoeffisienten) til den i. kjemiske arten ved bølgelengden λ, c jeg er dens konsentrasjon. Når konsentrasjonene er beregnet som ovenfor og absorbansen er målt for prøver med forskjellige konsentrasjoner av vert og gjest, gir Beer-Lambert-loven et sett med ligninger, ved en gitt bølgelengde, det som kan løses med lineære minste kvadrater prosess for de ukjente ekstinksjonskoeffisientverdiene ved den bølgelengden.
Fluorescensdata
Behandlingen av denne typen data ligner på behandlingen av absorbansdata. Faktisk er ligningen som definerer forholdet mellom fluorescerende intensitet og artens konsentrasjoner veldig lik.
hvor er den fluorescerende intensiteten til den art ved enhetskonsentrasjon.
Kalorimetri
Varmen utviklet seg når en mengde vertsløsning tilsettes en løsning som inneholder gjesten, er summen av bidrag fra hver reaksjon
hvor er en målt varmeendringsverdi (korrigert for alle fremmede varmebidrag) ved datapunkt j , mengden varme som absorberes eller slippes ut når 1 mol av det i reaksjonsproduktet dannes og er den faktiske endringen i antall mol produktet på det datapunktet. beregnes ved å løse ligningene for massebalanse med gitte verdier for likevektskonstantene. Hvis likevektskonstantverdiene er kjent, kan standard entalpiendringen beregnes ved en lineær minst-kvadrat-prosess, ellers må en ikke-lineær metode for datatilpasning brukes.
Isotermisk titreringskalorimetri brukes ofte for å bestemme verdiene for både en likevektskonstant og den tilsvarende standard reaksjonsentalpi. Produsentene av ITC -instrumenter leverer noe programvare som disse mengdene kan hentes fra eksperimentelle dataverdier.
Generell komplekseringsreaksjon
For hver likevekt som involverer en vert, H og en gjest G
likevektskonstanten,, er definert som
Verdiene av de frie konsentrasjonene, og oppnås ved å løse massebalansens ligninger med kjente eller estimerte verdier for stabilitetskonstantene.
Deretter kan konsentrasjonene til hver komplekse art også beregnes som . Forholdet mellom en arts konsentrasjon og den målte mengden er spesifikt for måleteknikken, som angitt i hver seksjon ovenfor. Ved å bruke dette forholdet kan settet med parametere, stabilitetskonstantverdiene og verdiene for egenskaper som molar absorpsjonsevne eller spesifiserte kjemiske endringer, foredles ved en ikke-lineær forfineringsprosess med minst kvadrat . For en mer detaljert redegjørelse for teorien, se Bestemmelse av likevektskonstanter . Noen dedikerte dataprogrammer er oppført på Implementations .
Bestemmelse av standard entalpi og entropi endringsverdier
Tenk først på systemet der en løsning inneholder visse mengder av en vert, H , og en gjest, G , i likevekt med enkeltkomplekset HG .
Anta nå at en liten mengde gjest legges til en blanding av vert og gjest ved likevekt. En ny likevekt vil da bli etablert og en mengde varme, Q vil bli utviklet. Når denne mengden er målt og korrigert for instrumentelle faktorer, er den relatert til endringen i mengden av komplekset HG som er tilstede i løsningen.
hvor Δ H ⊖ er dannelsesentalpi , det vil entalpien for dannelse av 1 mol av komplekset, HG og er endringen i antall mol av arten HG i oppløsning.
Hvis verdien av likevektskonstanten,, er kjent, kan mengden beregnes ved å løse massebalansens ligninger før og etter tillegg (se #Enkel vert – gjestkompleksering ovenfor). Deretter kan verdien av Δ H ⊖ kan oppnås ved bruk av fremgangsmåten i lineær minste kvadraters passer med en serie av eksperimentelle verdier av Q .
Hvis verdien av K ikke er kjent, må en ikke-lineær finjustering av minste kvadrater utføres for å få de to parameterne, og . Når dataene innhentes ved bruk av en isotermisk titreringskalorimetri, leveres programvaren som kreves for beregningene av instrumentprodusenten.
Merk: bruk av van 't Hoff -ligningen for å beregne standardentalpiendringen blir avskrevet fordi verdien oppnådd ved hjelp av denne metoden sannsynligvis vil bli utsatt for overdreven feil .
Generelt, når m -komplekser dannes, er varmen som utvikles ved k "titreringspunktet" summen av bidragene som følge av en endring i konsentrasjon av et reaksjonsprodukt.
Det er 2m parameter som skal bestemmes, en standard entalpiendring og en likevektskonstant for dannelsen av hvert reaksjonsprodukt. ITC -instrumentprodusenter leverer noen få spesifikke programvareprodukter som flere parameterverdier kan beregnes med. Dataprogrammer for den generelle saken, for eksempel HypΔH . Affinimeter ITC er også tilgjengelig.
Når verdiene for hver standard entalpiendring og likevektskonstant er bestemt, kan verdien av den tilsvarende standardentropiendringen avledes fra uttrykket
ved en gitt temperatur, T .
Eksperimentelle teknikker
Kjernemagnetisk resonans
Kjernemagnetisk resonans (NMR) er en av de kraftigste spektroskopiske teknikkene innen analytisk kjemi. Det er et viktig verktøy for studier av vert -gjest -komplekser, for å belyse strukturene til de forskjellige kompleksene som eksisterer i form av aggregater, ionepar eller innkapslede systemer. Som navnet antyder, identifiserer NMR de forskjellige kjernene i molekylene (oftest proton ) ved å måle deres kjemiske skift . Bindingsaktiviteten til to molekyler forårsaker en betydelig endring i deres elektroniske miljøer. Dette fører til et skifte i signalene i NMR -spekteret, og dette grunnleggende prinsippet brukes til å studere fenomenene kjemi i vert -gjest. Drivkreftene for vert -gjest -binding er de forskjellige sekundære interaksjonene mellom molekyler, for eksempel hydrogenbinding og pi -pi -interaksjon . Dermed fungerer NMR også som en viktig teknikk for å etablere tilstedeværelsen av disse interaksjonene i et vert -gjest -kompleks.
Tidligere NMR -studier har gitt nyttig informasjon om bindingen av forskjellige gjester til verter. Fox et al. beregnet hydrogenbindingsinteraksjonene mellom pyridinmolekyler og poly (amidoamin (PAMAM) dendrimer ; på grunnlag av det kjemiske skiftet av aminet og amidgruppene . I en lignende studie titrerte Xu et al. titrert karboksylatbasert G4 PAMAM dendrimer ( verten) med forskjellige aminbaserte legemidler (gjestene) og overvåket de kjemiske skiftene til dendrimeren. I forbindelse med 2D- NOESY NMR-teknikkene, var de i stand til å nøyaktig lokalisere legemidlets posisjon på dendrimerer og effekten av funksjonalitet De fant avgjørende bevis for at de kationiske legemiddelmolekylene fester seg på overflaten av anioniske dendrimerer ved elektrostatiske interaksjoner, mens et anionisk stoff lokaliserer både i kjernen og overflaten av dendrimerer, og at styrken av disse interaksjonene er avhengige av molekylenes pKa -verdier.
I en annen studie, Sun et al. studerte vertskjemkjemien til ruthenium trisbipyridyl-viologenmolekyler med cucurbituril . Mens overvåke endringen i den kjemiske skift av pyridin protoner på viologen , fant de at bindingsmåter for 1: 1-komplekser er helt forskjellig for forskjellige cucurbituril molekyler.
En viktig faktor som må tas i betraktning når man analyserer bindingen mellom verten og gjesten, er tiden det tar for datainnsamling sammenlignet med tiden for bindingshendelsen. I mange tilfeller er bindingshendelsene mye raskere enn tidsskalaen for datainnsamling, i så fall er utgangen et gjennomsnittssignal for de enkelte molekylene og komplekset. NMR -tidsskalaen er i størrelsesorden millisekunder, som i visse tilfeller når bindingsreaksjonen er rask, begrenser teknikkens nøyaktighet.
Ultrafiolett - synlig spektroskopi
Ultrafiolett -synlig spektroskopi er en av de eldste og raskeste metodene for å studere bindingsaktiviteten til forskjellige molekyler. Absorpsjonen av UV-lys skjer på en tidsskala av pikosekunder , og derfor kan individuelle signaler fra arten observeres. På samme tid korrelerer intensiteten av absorpsjon direkte med konsentrasjonen av arten, noe som muliggjør enkel beregning av assosiasjonskonstanten. Vanligvis er enten verten eller gjesten gjennomsiktig for UV-lys, mens det andre molekylet er UV-sensitivt. Endringen i konsentrasjonen av de UV-følsomme molekylene blir dermed overvåket og montert på en rett linje ved bruk av Benesi-Hildebrand-metoden , hvorfra assosiasjonskonstanten kan beregnes direkte.
Ytterligere informasjon om støkiometrien til kompleksene fås også, ettersom Benesi - Hilderbrand -metoden forutsetter en 1: 1 -støkiometri mellom verten og gjesten. Dataene vil bare gi en rett linje hvis den komplekse formasjonen også følger en lignende 1: 1 støkiometri. Et nylig eksempel på en lignende beregning ble gjort av Sun et al., Hvor de titrerte ruthenium trisbipyridyl-viologenmolekyler med cucurbit [7] urils og plottet den relative absorbansen av cucurbit-molekylene som en funksjon av dens totale konsentrasjon ved en bestemt bølgelengde. Dataene passet fint til en 1: 1 bindingsmodell med en bindingskonstant på .
Som en forlengelse kan man tilpasse dataene til forskjellige støkiometrier for å forstå kinetikken til bindingshendelsene mellom verten og gjesten. benyttet seg av denne konsekvensen for å modifisere det konvensjonelle Benesi-Hilderbrand-plottet for å få rekkefølgen på komplekseringsreaksjonen mellom bariumholdige kroneeter-broerte kirale heterotrinukleære salen Zn (II) -kompleks (vert) med forskjellige gjester imidazoler og aminosyre metylestere, sammen med de andre parameterne. De titrerte en fast konsentrasjon av sinkkomplekset med varierende mengder imidazoler og metylestere mens de overvåket endringene i absorbansen av pi-til-pi* overgangsbåndet ved 368 nm. Dataene passer til en modell der forholdet mellom gjest-til-vert er 2 i komplekset. De utførte disse eksperimentene videre ved forskjellige temperaturer som gjorde dem i stand til å beregne de forskjellige termodynamiske parametrene ved å bruke van 't Hoff -ligningen .
Isotermisk titreringskalorimetri
Spektroskopiske teknikker gi informasjon om bindingskonstant og Gibbs fri energi , . For å få det komplette settet med termodynamiske parametere som og , ville en van 't Hoff -analyse ved hjelp av van' t Hoff -ligningen være nødvendig. Imidlertid åpner de siste fremskrittene for kalorimetriske teknikker for måling av og i et enkelt eksperiment, og muliggjør dermed bestemmelse av alle de termodynamiske parametrene ved å bruke ligningen:
forutsatt at eksperimentet utføres under isotermiske forhold; derav navnet isotermisk kalorimetri. Fremgangsmåten ligner en konvensjonell titreringsprosedyre hvor verten tilsettes sekvensielt til gjesten og varmen som absorberes eller utvikles måles, sammenlignet med en blank løsning. Den totale varmen som frigjøres, Q , tilsvarer assosiasjonskonstanten , og ved ligningen:
Som kan forenkles som
Hvor
- = Innledende molar konsentrasjon av verten
- = Molar konsentrasjon av gjesten
- = fartøyets volum
Ovenstående ligning kan løses ved ikke-lineær regresjonsanalyse for å oppnå verdien av og og deretter og for den spesielle reaksjonen. Fordelene med isotermisk titreringskalorimetri fremfor de andre vanlige teknikkene, bortsett fra å gi hele settet med termodynamiske parametere, er at den er mer generell og egnet for et bredt spekter av molekyler. Det er ikke nødvendig å ha forbindelser med kromoforer eller UV-synlige funksjonelle grupper for å overvåke bindingsprosessen ettersom varmesignalet er en universell egenskap for bindingsreaksjoner. Samtidig er signal-støy-forholdet ganske gunstig, noe som muliggjør mer nøyaktig bestemmelse av bindingskonstantene, selv under svært fortynnede forhold. Et nylig eksempel på bruk av denne teknikken var for å studere bindingsaffiniteten til proteinmembranen som omgir Escherichia coli til lipofile kationer som brukes i legemidler i forskjellige membranmimetiske miljøer. Motivasjonen for studien ovenfor var at disse membranene gjør bakteriene resistente mot de fleste forbindelser basert på kvaternært ammoniumkation , som har de antibakterielle effektene. Således ville en forståelse av de bindende fenomenene muliggjøre utforming av effektive antibiotika for E. coli . Forskerne opprettholdt et stort overskudd av liganden over proteinet slik at bindingsreaksjonen kan fullføres. Ved å bruke de ovenstående ligninger forskerne fortsatte å beregne , , og for hvert stoff i forskjellige miljøer. Dataene indikerte at bindingsstøkiometrien til legemidlet med membranen var 1: 1 med en mikromolær verdi på . De negative verdiene av , og indikerte at prosessen var entalpidrevet med en verdi på 8–12 kcal/mol for hvert legemiddel.
applikasjoner
Raman -spektroskopi
Raman -spektroskopi er en spektroskopisk teknikk som brukes i studiet av molekyler som viser en Raman -spredningseffekt når monokromatisk lys forekommer på den. Det grunnleggende kravet for å få et Raman -signal er at det innfallende lyset fører til en elektronisk overgang i den kjemiske arten fra dens grunntilstand til en virtuell energitilstand, som vil avgi et foton ved retur til grunntilstanden. Forskjellen i energi mellom det absorberte og det utsendte fotonet er unikt for hver kjemiske art, avhengig av dets elektroniske miljø. Derfor fungerer teknikken som et viktig verktøy for å studere forskjellige bindingshendelser, ettersom binding mellom molekyler nesten alltid resulterer i en endring i deres elektroniske miljø. Det som gjør Raman -spektroskopi til en unik teknikk er imidlertid at bare overganger som er ledsaget av en endring i polarisasjonen av molekylet, er Raman -aktive. Den strukturelle informasjonen avledet fra Raman -spektra gir svært spesifikk informasjon om den elektroniske konfigurasjonen av komplekset sammenlignet med de enkelte verts- og gjestemolekylene.
Løsningsfase Raman-spektroskopi resulterer ofte i et svakt spredningstverrsnitt. Derfor er det gjort siste fremskritt for å forbedre Raman -signalene, for eksempel overflateforbedret Raman -spektroskopi og resonans Raman -spektroskopi . Slike teknikker tjener et ytterligere formål med å kvantifisere analyt-reseptorbindingshendelsene, og gir et mer detaljert bilde av fenomenene vert-gjestkompleksering der de faktisk finner sted, dvs. i løsninger. I et nylig gjennombrudd har Flood et al. bestemte bindingsstyrken til tetrathiafulvalene (TTF) og cyclobis (paraquat-p-fenylen) ved bruk av Raman-spektroskopi samt SERS . Tidligere arbeid på dette feltet var rettet mot å gi informasjon om bindingen og strukturen til det resulterende komplekset, i stedet for kvantitative målinger av foreningens styrker. Forskerne måtte bruke Resonance Raman -spektroskopi for å kunne få påviselige signaler fra løsninger med konsentrasjoner så lave som 1 mM. Spesielt korrelerte de intensiteten til Raman-bandene med kompleksets geometri i den fotoopphissede tilstanden. I likhet med titrering basert på ultrafiolett -synlig spektroskopi, beregnet de bindingskonstanten med "Raman -titrering" og tilpasset bindingskurvene til 1: 1 -modeller, og ga en på -5,7 ± 0,6 kcal/mol. Studien gir nå grunnlag for lignende studier som involverer kostnadsoverføringskomplekser i løsninger.
Samarbeid
Kooperativitet er definert som når en ligand binder seg til en reseptor med mer enn ett bindingssted, og liganden forårsaker en reduksjon eller økning i affinitet for innkommende ligander. Hvis det er en økning i binding av de påfølgende ligandene, regnes det som positiv kooperativitet. Hvis en reduksjon av binding observeres, er det negativ kooperativitet. Eksempler på positiv og negativ kooperativitet er henholdsvis hemoglobin og aspartatreseptor.
De siste årene har kooperativitetens termodynamiske egenskaper blitt studert for å definere matematiske parametere som skiller positiv eller negativ kooperativitet. De tradisjonelle Gibbs fri energi ligningen sier: . For å kvantifisere kooperativitet i et vert -gjest -system må imidlertid bindingsenergien vurderes. Skjematikken til høyre viser bindingen av A, binding av B, positiv kooperativ binding av A – B, og til slutt negativ kooperativ binding av A – B. Derfor vil en alternativ form for Gibbs ligning for fri energi være
hvor:
- = fri energi for binding A
- = fri energi for binding B
- = fri bindingsenergi for A og B knyttet
- = summen av de frie energiene for binding
Det anses at hvis det er mer enn summen av og , er det positivt samarbeidende. Hvis er mindre, så er det negativt samarbeidende. Vert-gjest-kjemi er ikke begrenset til reseptor-lingand-interaksjoner. Det er også demonstrert i ion-paringssystemer. I de siste årene har slike interaksjoner blitt studert i et vandig medium ved bruk av syntetiske organometalliske verter og organiske gjestemolekyler. For eksempel er en poly-kationisk reseptor som inneholder kobber (verten) koordinert med molekyler som tetrakarboksylater, trikarballat, aspartat og acetat (gjestene). Denne studien illustrerer at entropi snarere enn entalpi bestemmer bindingsenergien til systemet som fører til negativ kooperativitet. Den store endringen i entropi stammer fra forskyvning av løsningsmiddelmolekyler som omgir liganden og reseptoren. Når flere acetater binder seg til reseptoren, frigjør det flere vannmolekyler til miljøet enn et tetrakarboksylat. Dette førte til en nedgang i fri energi som innebar at systemet samarbeider negativt. I en lignende studie, ved bruk av guanidinium og Cu (II) og polykarboksylatgjester, er det vist at positivt samarbeid i stor grad bestemmes av entalpi. I tillegg til termodynamiske studier har kjemi fra vert -gjest også biologiske anvendelser.
Superledning
Ved lave temperaturer og høyt trykk har det vist seg at vismut viser en vert -gjestestruktur. Dette fører overraskende til sterk kobling av superledning.
Biologisk anvendelse
Dendrimers i legemiddelleveringssystemer er et eksempel på ulike vert-gjest-interaksjoner. Interaksjonen mellom vert og gjest, henholdsvis dendrimeren og stoffet, kan enten være hydrofob eller kovalent. Hydrofob interaksjon mellom vert og gjest regnes som "innkapslet", mens kovalente interaksjoner anses å være konjugerte. Bruken av dendrimerer i medisin har vist seg å forbedre legemiddeltilførselen ved å øke oppløseligheten og biotilgjengeligheten av stoffet. Sammen kan dendrimerer øke både mobilopptak og målrettet evne, og redusere legemiddelresistens.
Løseligheten til forskjellige ikke-steroide antiinflammatoriske legemidler (NSAID) øker når de er innkapslet i PAMAM-dendrimerer. Denne studien viser at forbedringen av NSAID -løseligheten skyldes de elektrostatiske interaksjonene mellom overflatamingruppene i PAMAM og karboksylgruppene som finnes i NSAID. Bidrag til økningen i løselighet er de hydrofobe interaksjonene mellom de aromatiske gruppene i legemidlene og de indre hulrommene i dendrimeren. Når et legemiddel er innkapslet i en dendrimer, forblir dets fysiske og fysiologiske egenskaper uendret, inkludert ikke-spesifisitet og toksisitet. Imidlertid, når dendrimeren og stoffet er kovalent koblet sammen, kan det brukes til spesifikk vevsmålretting og kontrollerte frigjøringshastigheter. Kovalent konjugering av flere legemidler på dendrimeroverflater kan utgjøre et problem med uløselighet.
Dette prinsippet studeres også for kreftbehandling. Flere grupper har innkapslet medisiner mot kreft som: Camptothecin , Methotrexate og Doxorubicin . Resultater fra denne forskningen har vist at dendrimerer har økt vandig løselighet, redusert frigjøringshastighet og muligens kontrollert cytotoksisitet av legemidlene. Cisplatin har blitt konjugert til PAMAM -dendrimerer som resulterte i de samme farmakologiske resultatene som nevnt ovenfor, men konjugeringen hjalp også med å akkumulere cisplatin i solide svulster ved intravenøs administrering.
Sensing
Tradisjonelt har kjemisk sensing blitt nærmet med et system som inneholder en kovalent bundet indikator til en reseptor gjennom en linker. Når analytten binder seg, endrer indikatoren farge eller fluorescerer. Denne teknikken kalles indikator-spacer-reseptor-tilnærmingen (ISR). I motsetning til ISR benytter indikator-forskyvningsanalyse (IDA) en ikke-kovalent interaksjon mellom en reseptor (verten), indikator og en analyt (gjesten). I likhet med ISR bruker IDA også kolorimetriske (C-IDA) og fluorescens (F-IDA) indikatorer. I en IDA -analyse inkuberes en reseptor med indikatoren. Når analytten tilsettes blandingen, slippes indikatoren ut i miljøet. Når indikatoren er sluppet, endrer den enten farge (C-IDA) eller fluorescerer (F-IDA).
IDA tilbyr flere fordeler kontra den tradisjonelle ISR -metoden for kjemisk sansing. For det første krever det ikke at indikatoren er kovalent bundet til reseptoren. For det andre, siden det ikke er noen kovalent binding, kan forskjellige indikatorer brukes med den samme reseptoren. Til slutt er mediene der analysen kan brukes, mangfoldige.
Kjemiske sanseteknikker som C-IDA har biologiske implikasjoner. For eksempel er protamin en koagulant som administreres rutinemessig etter kardiopulmonal kirurgi som motvirker den anti-koagulerende aktiviteten til herapin. For å kvantifisere protaminen i plasmaprøver, brukes en kolorimetrisk forskyvningsanalyse. Azure A -fargestoff er blått når det er ubundet, men når det er bundet til herapin, viser det en lilla farge. Bindingen mellom Azure A og heparin er svak og reversibel. Dette gjør at protamin kan forskyve Azure A. Når fargestoffet er frigjort, viser det en lilla farge. I hvilken grad fargestoffet forskyves er proporsjonalt med mengden protamin i plasmaet.
F-IDA har blitt brukt av Kwalczykowski og medarbeidere til å overvåke aktivitetene til helikase i E.coli . I denne studien brukte de tiazolorange som indikator. Helikasen avvikler dsDNA for å lage ssDNA. Fluorescensintensiteten til tiazolorange har en større affinitet for dsDNA enn ssDNA, og fluorescensintensiteten øker når den er bundet til dsDNA enn når den er ubundet.
Konformasjonsbytte
Et krystallinsk fast stoff har tradisjonelt blitt sett på som en statisk enhet hvor bevegelsene til atomkomponentene er begrenset til dens vibrasjons likevekt. Som sett av transformasjonen av grafitt til diamant, kan fast til fast transformasjon oppstå under fysisk eller kjemisk trykk. Det har nylig blitt foreslått at transformasjonen fra et krystallarrangement til et annet skjer på en samarbeidende måte. De fleste av disse studiene har vært fokusert på å studere et organisk eller metall-organisk rammeverk. I tillegg til studier av makromolekylær krystallinsk transformasjon, er det også studier av enkeltkrystallmolekyler som kan endre deres konformasjon i nærvær av organiske løsningsmidler. Et organometallisk kompleks har vist seg å forandre seg i forskjellige retninger, avhengig av om det er utsatt for løsemiddeldamp eller ikke.
Miljøapplikasjoner
Gjestesystemer har blitt brukt til å fjerne farlige materialer fra miljøet. De kan lages i forskjellige størrelser og forskjellige former for å fange en rekke kjemiske gjester. En anvendelse er p-tert-butycalix [4] arens evne til å fange et cesiumion. Cesium-137 er radioaktivt, og det er behov for å fjerne det fra atomavfall på en effektiv måte. Vert-gjest-kjemi har også blitt brukt til å fjerne kreftfremkallende aromatiske aminer og deres N-nitroso-derivater fra vann. Disse avfallsmaterialene brukes i mange industrielle prosesser og finnes i en rekke produkter som: plantevernmidler, medisiner og kosmetikk.



![{\ displaystyle K_ {a}^{\ ominus} = {\ frac {\ {HG \}} {\ {H \} \ {G \}}} = {\ frac {[HG]} {[H] [ G]}} \ ganger \ Gamma}](https://wikimedia.org/api/rest_v1/media/math/render/svg/9754da7964a0bf1e4808d376020a6e8e25c207f8)
![{\ displaystyle [HG]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/80fdda7af86666fc9f3342541e225ac292bb9a81)
![{\ displaystyle [H]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/59d2226487b5eb5f8a607d7233b5825b05775db6)
![{\ displaystyle [G]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/3b230fd410e2cd9ecc472bb1de122c0b523f561c)

![{\ displaystyle K_ {a} = {\ frac {[HG]} {[H] [G]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/ae235e284e33c2c110956324a712e6c6962507e0)





![{\ displaystyle K = {\ frac {[HG]} {[H] [G]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/f0699f3a1a1574661940baea1c8bbfb4a3136447)
![{\ displaystyle T_ {H} = [H]+K [H] [G]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/4ef4c10eece3b96f87a168ce59d82e54e4c5d249)
![{\ displaystyle T_ {G} = [G]+K [H] [G]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/1246c000c420a8e140e2ef3450c8ed780b7eea5b)


![{\ displaystyle [H] = T_ {H} -T_ {G}+[G]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/4cab49660f203c07b5f2b895ab2f8c1545cbbd8c)
![{\ displaystyle [HG] = K [H] [G]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/e88c585a975e89e21c0933648c84b4fdedd50c12)





















![{\ displaystyle \ beta _ {pq} = {\ frac {[H_ {p} G_ {q}]} {[H]^{p} [G]^{q}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/db509ff939d1eb629ba6b10c11abc7b380a95c76)
![{\ displaystyle T_ {H} = [H]+\ sum p \ beta _ {pq} [H]^{p} [G]^{q}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/e85683a8e3d63267f6160f59ea79b76f9f87ba74)
![{\ displaystyle T_ {G} = [G]+\ sum q \ beta _ {pq} [H]^{p} [G]^{q}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/515652e9c3e3cd95a67682abf6e924937de71da8)
![{\ displaystyle [H_ {p} G_ {q}] = \ beta _ {pq} [H]^{p} [G]^{q}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/ae16c12c4b85d02e4add18af69d42131945ce0e8)














![{\ displaystyle Q = {V \ Delta H_ {0} [HG]}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/05741345df5c805bd41d52801bd5df273f77089c)
![{\ displaystyle Q = {\ frac {V \ Delta H_ {0} K_ {a} [H_ {0}] [G]} {1+K_ {a} [G]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/68c72903aa7b75076ad27a613a05847bfcc18e9e)
![{\ displaystyle [H_ {0}]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/b09a9868564ad3a8fc85cbdf4abab3df406316f8)













