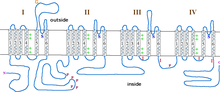
L -type kalsiumkanal - L-type calcium channel
| Kalsiumkanal, spenningsavhengig | |
|---|---|
 Krystallografisk struktur
| |
| Identifikatorer | |
| Symbol | Kalsiumkanal, spenningsavhengig |

Den L-type kalsiumkanal (også kjent som den dihydropyridin-kanalen, eller DHP-kanalen ) er en del av den høyspente aktivert familie av spenningsavhengig kalsiumkanal . "L" står for langvarig og refererer til aktiveringslengden. Denne kanalen har fire underenheter ( Cav1.1 , Cav1.2 , Cav1.3 , Cav1.4 ).
L-typen av kalsiumkanaler er ansvarlig for den excitation- sammentrekning koblingen av skjelett , glatt , hjertemuskel , og for aldosteron -sekresjon i endokrine celler i binyrebarken . De finnes også i nevroner, og ved hjelp av kalsiumkanaler av L-type i endokrine celler regulerer de nevrohormoner og nevrotransmittere . De har også sett å spille en rolle i genuttrykk, mRNA-stabilitet, neuronal overlevelse, iskemisk indusert aksonal skade, synaptisk effekt og både aktivering og deaktivering av andre ionekanaler.
I hjertemyocytter passerer kalsiumkanalen av L-typen innover Ca 2+ -strøm og utløser kalsiumfrigjøring fra sarkoplasmatisk retikulum ved å aktivere ryanodinreseptor 2 (RyR2) (kalsiumindusert-kalsiumfrigjøring). Fosforylering av disse kanalene øker deres permeabilitet for kalsium og øker kontraktiliteten til deres respektive hjertemyocytter.
Kalsiumkanalblokkere av L-type brukes som hjerte- antiarytmika eller antihypertensiva , avhengig av om legemidlene har høyere affinitet for hjertet ( fenylalkylaminene , som verapamil ), eller for blodårene ( dihydropyridinene , som nifedipin ).
I skjelettmuskulatur er det en veldig høy konsentrasjon av L-type kalsiumkanaler, som ligger i T-tubuli . Muskeldepolarisering resulterer i store gatingstrømmer, men unormalt lav kalsiumfluks, som nå forklares med den veldig sakte aktiveringen av ionestrømmene. Av denne grunn passerer lite eller ingen Ca 2+ over T-tubulamembranen under et enkelt handlingspotensial.
Historie
I 1953 oppdaget Paul Fatt og Bernard Katz spenningslukkede kalsiumkanaler i kreftdyrmusklene. Kanalene viste forskjellige aktiveringsspenninger og kalsiumledende egenskaper og ble dermed separert i høyspenningsaktiverende kanaler (HVA) og lavspenningsaktiverende kanaler (LVA). Etter ytterligere eksperimentering ble det funnet at HVA-kanaler ville åpne for 1,4-dihydropyridin ( DHP ). Ved å bruke DHP fant de at HVA-kanaler var spesifikke for visse vev og reagerte annerledes, noe som førte til ytterligere kategorisering av HVA-kanalene i L-type, P-type og N-type . L-kalsiumkanaler ble sekvensert av peptider, og det ble funnet at det var 4 typer kalsiumkanaler av L-type: α 1 S (skjelettmuskulatur), α 1 C (hjerte), α 1 D (funnet i hjernen) og α 1 F (funnet i netthinnen). I 2000, etter at det ble forsket mer på α 1- underenheter i spenningsstyrte kalsiumkanaler, ble det brukt en ny nomenklatur som kalte L-type kalsiumkanaler CaV1, og dens underenheter ble kalt CaV1.1 , Cav1.2 , CaV1.3 og CaV1.4 . Forskning på CaV1 -underenhetene fortsetter å avsløre mer om deres struktur, funksjon og farmasøytiske applikasjoner.
Struktur
Kalsiumkanaler av L-type inneholder 5 forskjellige underenheter, α1 (170–240 kDa), α2 (150 kDa), δ (17-25 kDa), β (50-78 kDa) og γ (32 kDa) underenheter. Α2, δ og β-underenhetene er ikke-kovalent bundet til α1-underenheten og modulerer ionetrafikk og biofysiske egenskaper til α1-underenheten. Α2 og δ subenhetene er i det ekstracellulære rommet mens β og γ subenhetene er lokalisert i det cytosoliske rommet.
Α1-underenheten er en heterotetramer som har fire transmembrane regioner , kjent som domener I-IV, som krysser plasma seks ganger som α-spiraler , og kalles S0-S6 (S0 og S1 krysser membranen sammen en gang). Α1 -underenheten som helhet inneholder spenningsfølerområdet, ledningsporen og gatingapparatet. Som de fleste spenningsstyrte ionekanaler , består α-subenheten av 4 underenheter. Hver underenhet er dannet av 6 alfa-spiralformede, transmembrane domener som krysser membranen (nummerert S1-S6). S1-S4-underenhetene utgjør spenningssensoren, mens S5-S6-underenhetene utgjør selektivitetsfilteret. For å kjenne cellens spenning inneholder S1-S3 spiraler mange negativt ladede aminosyrer aminosyrer mens S4 spiraler inneholder for det meste positivt ladede aminosyrer med en P-loop som forbinder S4 med S5 spiraler. Etter S1-6-domenene er det seks C-domener som består av to EF-håndmotiver (C1-2 og C3-4) og et Pre-IQ-domene (C5) og IQ-domene (C6). Det er også to EF-håndmotiver på N-terminalen. Både N- og C-enden er i det cytosoliske rommet med C-enden mye lengre enn N-enden.
Det er kjent at β-underenheten har fire isoformer (β1-β4) for å regulere kanalens funksjoner og er koblet til α1 gjennom α1 I og II linker i cytosolen ved β α1- bindingslommen (ABP). Hver isoform inneholder et src-homologi 3-domene (SH3) og et guanylat-kinase-lignende domene (GK) som er atskilt med et HOOK-domene og tre ustrukturerte regioner.
Α2 og δ -underenhetene er koblet sammen med disulfidbindinger (noen ganger kjent som α2δ -underenheten) og samhandler med α1. de har fire kjente isoformer som kalles α2δ-1 til α2δ-2 og inneholder et von Willebrand A (VWA) domene og et Cache-domene . Α2 -regionen er i det ekstracellulære rommet mens δ -regionen er i cellemembranen og har blitt sett på forankret med et glykosylfosfatidylinositol (GPI) anker.
Y-underenheten har åtte isoformer (γ1-γ8) og er koblet til α1-underenheten og har bare blitt funnet i muskelceller i CaV1.1- og CaV1.2-kanalene. Ikke mye er kjent om γ -underenheten, men den har vært knyttet til interaksjoner i hydrofobe krefter.
Mekanisme
Åpning av poren i kalsiumkanaler av L-type finner sted i α1-underenheten. Når membranen depolariserer, beveger S4 -helixen seg gjennom S4- og S5 -linkerne til de cytoplasmatiske ender av S5- og S6 -helixene. Dette åpner aktiveringsporten som dannes av innsiden av S6 -helixene i α1 -underenheten.
Den mest dominerende måten for autoinhibering av kalsiumkanaler av L-type er med Ca 2+ /Cam-komplekset. Når porene åpnes og forårsaker en tilstrømning av kalsium, binder kalsium seg til calmodulin og samhandler deretter med sløyfen som forbinder de tilstøtende EF-håndmotivene og forårsaker en konformasjonsendring i EF-håndmotivet, slik at det samhandler med porene for å forårsake rask inhibering. i kanalen. Det diskuteres fortsatt om hvor og hvordan porene og EF-hånden samhandler. Hydrofobe lommer i Ca 2+ /Cam -komplekset vil også binde seg til tre deler av IQ -domenet kjent som "aromatiske ankre". Den Ca 2+ / Cam komplekset har en høy affinitet mot L-typen av kalsiumkanaler, slik at den blir blokkert selv når det er små mengder av kalsium tilstede i cellen. Poren lukker seg etter hvert som cellen repolariseres og forårsaker en konformasjonsendring i kanalen for å sette den i den lukkede konformasjonen.
Inhibering og modulering
En av de mest kjente egenskapene til L-type kalsiumkanal er dens unike følsomhet overfor 1,4-dihydropyridiner (DHP) . I motsetning til andre spenningsgatede kalsiumkanaler, er kalsiumkanaler av L-typen resistente mot ⍵-CT X (GVIA) og ⍵-AG A (IVA) hemmende legemidler.
En godt observert form for modulering skyldes alternativ spleising . En vanlig form for modulering fra alternativ spleising er C-terminalmodulatoren (CTM). Den har en positivt ladet α-helix på C-terminalen kalt DCRD og en negativt ladet helix rett etter IQ-motivet (CaM-interaksjonsstedet) kalt PCRD. De to spiralene kan danne en struktur som binder seg konkurransedyktig med CaM for å redusere sannsynligheten for åpen tilstand og lavere kalsiumavhengig inhibering (CDI).
Alternativ spleising sees også på β -underenhetene for å lage forskjellige isoformer for å gi kanalene forskjellige egenskaper på grunn av palmitoylering og RNA -redigering . Andre former for modulering på β -underenheten inkluderer økning eller reduksjon av underenhetens uttrykk. Dette skyldes det faktum at β-underenheter øker kanalens åpne sannsynlighet, aktivitet i plasmamembranen og motvirker ubiquitinering av kanalen.
L-kalsiumkanaler moduleres også av G-proteinkoblede reseptorer og det adrenerge nervesystemet . Proteinkinase A (PKA) aktivert av en G-proteinkoblede reseptorkaskade kan fosforylere kalsiumkanaler av L-typen, etter at kanaler danner et signalkompleks med A-Kinase-forankringsproteiner (AKAP) , for å øke kalsiumstrømmen gjennom kanalen, øke åpen tilstandssannsynlighet og en akselerert gjenopprettingsperiode. Aktivert fosfolipase C (PLC) fra G-proteinkoblede reseptorer kan bryte ned polyfosfoinositider for å redusere kanalene kalsiumstrøm med 20%-30%.
Det adrenerge nervesystemet har blitt sett på å modulere kalsiumkanaler av L-typen ved å spalte det C-terminale fragmentet når β-adrenerge reseptoren stimuleres til å øke aktiveringen av kanalene.
Gener
Se også
Referanser
Videre lesning
- Takahashi K, Hayashi S, Miyajima M, Omori M, Wang J, Kaihara K, et al. (Mai 2019). "Kalsiumkanal av L-typen modulerer mekanosensitiviteten til kardiomyocyttcellelinjen H9c2" . Cellekalsium . 79 : 68–74. doi : 10.1016/j.ceca.2019.02.008 . PMID 30836292 .
Denne artikkelen inneholder tekst fra United States National Library of Medicine , som er i offentlig regi .
Eksterne linker
- "Spenningsgatede kalsiumkanaler" . IUPHAR Database of Receptors and Ion Channels . International Union of Basic and Clinical Pharmacology.
- L-Type+Calcium+Channel ved US National Library of Medicine Medical Subject Headings (MeSH)