Trombocytavledet vekstfaktorreseptor - Platelet-derived growth factor receptor
| Trombocytavledet vekstfaktorreseptor | |||||||||
|---|---|---|---|---|---|---|---|---|---|
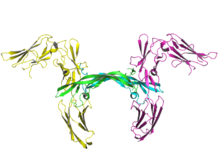 Båndbilde av to molekyler av human PDGF-reseptor beta (gul og magenta) i kompleks med dimer PDGF-B (cyan og grønn).
| |||||||||
| Identifikatorer | |||||||||
| Symbol | PDGFR | ||||||||
| Pfam | PF04692 | ||||||||
| InterPro | IPR006782 | ||||||||
| Membranome | 1204 | ||||||||
| |||||||||
| blodplateavledet vekstfaktorreseptor, alfa-polypeptid | |||||||
|---|---|---|---|---|---|---|---|
| Identifikatorer | |||||||
| Symbol | PDGFRA | ||||||
| NCBI -gen | 5156 | ||||||
| HGNC | 8803 | ||||||
| OMIM | 173490 | ||||||
| RefSeq | NM_006206 | ||||||
| UniProt | P16234 | ||||||
| Andre data | |||||||
| Lokus | Chr. 4 q12 | ||||||
| |||||||
| blodplateavledet vekstfaktorreseptor, beta-polypeptid | |||||||
|---|---|---|---|---|---|---|---|
| Identifikatorer | |||||||
| Symbol | PDGFRB | ||||||
| Alt. symboler | PDGFR | ||||||
| NCBI -gen | 5159 | ||||||
| HGNC | 8804 | ||||||
| OMIM | 173410 | ||||||
| RefSeq | NM_002609 | ||||||
| UniProt | P09619 | ||||||
| Andre data | |||||||
| Lokus | Chr. 5 q31-q32 | ||||||
| |||||||
Blodplateavledede vekstfaktorreseptorer ( PDGF-R ) er tyrosinkinasereseptorer på celleoverflaten for medlemmer av blodplateavledet vekstfaktor (PDGF) -familie. PDGF -underenheter -A og -B er viktige faktorer som regulerer cellespredning , celledifferensiering , cellevekst , utvikling og mange sykdommer, inkludert kreft . Det er to former for PDGF-R, alfa og beta hver kodet av et annet gen. Avhengig av hvilken vekstfaktor som er bundet, homo- eller heterodimeriserer PDGF-R.
Virkningsmekanismen
PDGF -familien består av PDGF -A, -B, -C og -D, som danner enten homo- eller hetero -dimerer (PDGF -AA, -AB, -BB, -CC, -DD). De fire PDGF -ene er inaktive i sine monomere former. PDGF bindes til proteintyrosinkinase -reseptorene PDGF reseptor -α og -β . Disse to reseptor -isoformer dimerisere ved binding PDGF-dimer, som fører til tre mulige reseptor-kombinasjoner, nemlig -αα, -ββ og -αβ. Den ekstracellulære regionen til reseptoren består av fem immunglobulinlignende domener mens den intracellulære delen er et tyrosinkinasedomene . Ligandbindingsstedene til reseptorene er lokalisert til de tre første immunglobulinlignende domenene. PDGF-CC interagerer spesifikt med PDGFR-αα og -αβ, men ikke med -ββ, og ligner derved PDGF-AB. PDGF-DD binder seg til PDGFR-ββ med høy affinitet, og til PDGFR-αβ i markant lavere grad og blir derfor sett på som PDGFR-ββ-spesifikk. PDGF-AA binder seg bare til PDGFR-αα, mens PDGF-BB er det eneste PDGF som kan binde alle tre reseptorkombinasjonene med høy affinitet.
Dimerisering er en forutsetning for aktivering av kinasen . Kinaseaktivering visualiseres som tyrosin- fosforylering av reseptormolekylene, som oppstår mellom de dimeriserte reseptormolekylene ( transfosforylering ). I forbindelse med dimerisering og kinaseaktivering gjennomgår reseptormolekylene konformasjonsendringer , som gjør at en basal kinaseaktivitet kan fosforylere en kritisk tyrosinrest , og dermed "låse opp" kinasen, noe som fører til full enzymatisk aktivitet rettet mot andre tyrosinrester i reseptormolekylene som så vel som andre substrater for kinasen. Uttrykk for begge reseptorer og hver av de fire PDGF -ene er under uavhengig kontroll, noe som gir PDGF/PDGFR -systemet en høy fleksibilitet. Ulike celletyper varierer sterkt i forholdet mellom PDGF -isoformer og PDGFR uttrykt. Ulike ytre stimuli som betennelse , embryonisk utvikling eller differensiering modulerer cellulær reseptoruttrykk som tillater binding av noen PDGF, men ikke andre. I tillegg viser noen celler bare en av PDGFR -isoformene mens andre celler uttrykker begge isoformene, samtidig eller separat.
Interaksjon med signaltransduksjonsmolekyler
Tyrosinfosforyleringssteder i vekstfaktorreseptorer tjener to hovedformål - å kontrollere kinasens aktivitetstilstand og å lage bindingssteder for nedstrøms signaltransduksjonsmolekyler , som i mange tilfeller også er substrater for kinasen. Den andre delen av tyrosinkinasedomenet i PDGFp-reseptoren fosforyleres ved Tyr-857, og mutante reseptorer som bærer fenylalanin i denne stillingen har redusert kinaseaktivitet. Tyr-857 har derfor blitt tildelt en rolle i positiv regulering av kinaseaktivitet. Steder for tyrosinfosforylering involvert i bindende signaltransduksjonsmolekyler er blitt identifisert i juxtamembrandomenet , kinaseinnsatsen og i den C-terminale halen i PDGFp-reseptoren. Den fosforylerte tyrosinresten og generelt tre tilstøtende C-terminale aminosyrerester danner spesifikke bindingssteder for signaltransduksjonsmolekyler. Binding til disse stedene innebærer en felles bevarte strekninger, betegnet Src -homologi (SH) 2 -domenet og/eller fosfotyrosinbindende domener (PTB). Spesifisiteten til disse interaksjonene ser ut til å være veldig høy, siden mutante reseptorer som bærer fenylalaninrester i ett eller flere av de forskjellige fosforyleringsstedene generelt mangler kapasitet til å binde det målrettede signaltransduksjonsmolekylet. Signaltransduksjonsmolekylene er enten utstyrt med forskjellige enzymatiske aktiviteter, eller de er adaptermolekyler, som i noen, men ikke alle tilfeller, finnes i komplekser med underenheter som bærer en katalytisk aktivitet. Ved interaksjon med den aktiverte reseptoren blir de katalytiske aktivitetene oppregulert gjennom tyrosinfosforylering eller andre mekanismer, og genererer et signal som kan være unikt for hver type signaltransduksjonsmolekyl.
Undersøkelse av de forskjellige signaleringskaskadene indusert av RTK etablerte Ras/mitogen-aktivert proteinkinase (MAPK), PI-3 kinase og fosfolipase-γ (PLCγ) veier som sentrale nedstrøms mediatorer av PDGFR-signalering. I tillegg har reaktive oksygenarter (ROS) -avhengig STAT3- aktivering blitt etablert for å være en sentral nedstrøms mediator for PDGFR-signalering i vaskulære glatte muskelceller.
MAPK -sti
Adapterproteinet Grb2 danner et kompleks med Sos av Grb2 SH3 -domenet . Grb2 (eller Grb2/Sos-komplekset) rekrutteres til membranen av Grb2 SH2-domenebindingen til aktivert PDGFR-bundet SHP2 (også kjent som PTPN11 , et cytosolisk PTP ), og tillater derved interaksjon med Ras og utveksling av BNP for GTP på Ras . Mens interaksjonen mellom Grb2 og PDGFR skjer gjennom interaksjon med SHP2 -proteinet, binder Grb2 i stedet til aktivert EGFR gjennom Shc , et annet adapterprotein som danner et kompleks med mange reseptorer via sitt PTB -domene . Når den er aktivert, samhandler Ras med flere proteiner, nemlig Raf. Aktiverte Raf stimulerer MAPK-kinase (MAPKK eller MEK) ved å fosforylere en serinrest i aktiveringssløyfen . MAPKK fosforylerer deretter MAPK (ERK1/2) på T- og Y-rester ved aktiveringssløyfen som fører til aktivering. Aktiverte MAPK fosforylerer en rekke cytoplasmatiske substrater, så vel som transkripsjonsfaktorer, når de translokeres til kjernen. Det er funnet at MAPK -familiemedlemmer regulerer forskjellige biologiske funksjoner ved fosforylering av bestemte målmolekyler (for eksempel transkripsjonsfaktorer, andre kinaser etc.) som befinner seg i cellemembranen, cytoplasma og kjerne, og dermed bidrar til regulering av forskjellige cellulære prosesser som celle spredning, differensiering, apoptose og immunresponser .
PI3K -sti
Klasse IA fosfolipid kinase, PI-3 kinase, aktiveres av de fleste RTK. På samme måte som andre SH2-domenholdige proteiner, danner PI-3 kinase et kompleks med PY-steder på aktiverte reseptorer. Hovedfunksjonen for PI3K -aktivering er generering av PIP3, som fungerer som en andre messenger for å aktivere nedstrøms tyrosinkinaser Btk og Itk, Ser/Thr -kinasene PDK1 og Akt (PKB). De viktigste biologiske funksjonene ved Akt -aktivering kan klassifiseres i tre kategorier - overlevelse, spredning og cellevekst. Akt er også kjent for å være involvert i flere kreftformer, spesielt bryst. PLCγ rekrutteres umiddelbart av en aktivert RTK gjennom binding av SH2 -domenene til fosfotyrosin -seter i reseptoren. Etter aktivering hydrolyserer PLCγ sitt substrat PtdIns (4,5) P2 og danner to andre budbringere, diacylglycerol og Ins (1,4,5) P3. Ins (1,4,5) P3 stimulerer frigjøring av Ca 2+ fra intracellulære forsyninger. Ca 2+ binder seg deretter til calmodulin, som deretter aktiverer en familie av kalmodulavhengige proteinkinaser (CamK). I tillegg aktiverer både diacylglyserol og Ca 2+ medlemmer av PKC -familien. De andre budbringerne generert av PtdIns (4,5) P2 -hydrolyse stimulerer en rekke intracellulære prosesser som proliferasjon, angiogenese, cellemotilitet.
Se også
- Reseptor tyrosinkinase
- PDGF
- Imatinib
- PDGFRA
- PDGFRB
- Crenolanib (CP-868,596-26)
Referanser
Eksterne linker
- Blodplateavledet+vekst+faktor+reseptorer ved US National Library of Medicine Medical Subject Headings (MeSH)
