Transient reseptor potensiell kanal - Transient receptor potential channel
| Transient reseptorpotensial (TRP) ionekanal | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Identifikatorer | |||||||||
| Symbol | TRP | ||||||||
| Pfam | PF06011 | ||||||||
| InterPro | IPR013555 | ||||||||
| OPM superfamilie | 8 | ||||||||
| OPM -protein | 3j5p | ||||||||
| Membranome | 605 | ||||||||
| |||||||||
Transiente reseptorpotensielle kanaler ( TRP -kanaler ) er en gruppe ionekanaler som hovedsakelig befinner seg på plasmamembranen til mange dyrecelletyper. De fleste av disse er gruppert i to brede grupper: Gruppe 1 inkluderer TRPC ("C" for kanonisk), TRPV ("V" for vanilloid), TRPVL ("VL" for vanilloidlignende), TRPM ("M" for melastatin) , TRPS ("S" for soromelastatin), TRPN ("N" uten mekanoreceptorpotensial C) og TRPA ("A" for ankyrin). Gruppe 2 består av TRPP ("P" for polycystisk) og TRPML ("ML" for mucolipin). Andre mindre godt kategoriserte TRP-kanaler finnes, inkludert gjærkanaler og en rekke gruppe 1 og gruppe 2-kanaler som finnes i ikke-dyr. Mange av disse kanalene formidler en rekke følelser som smerte, temperatur, forskjellige smaker, trykk og syn. I kroppen antas det at noen TRP -kanaler oppfører seg som mikroskopiske termometre og brukes hos dyr for å føle varmt eller kaldt. Noen TRP -kanaler aktiveres av molekyler som finnes i krydder som hvitløk ( allicin ), chilipepper ( capsaicin ), wasabi ( allylisotiocyanat ); andre aktiveres av mentol , kamfer , peppermynte og kjølemidler; enda andre aktiveres av molekyler som finnes i cannabis (dvs. THC , CBD og CBN ) eller stevia . Noen fungerer som sensorer for osmotisk trykk, volum, strekk og vibrasjon. De fleste kanalene blir aktivert eller hemmet av signalering av lipider og bidrar til en familie av lipidgaterte ionekanaler .
Disse ionekanalene har en relativt ikke-selektiv permeabilitet for kationer , inkludert natrium , kalsium og magnesium .
TRP -kanaler ble opprinnelig oppdaget i den såkalte "transient receptor potential" mutant ( trp -mutant) stamme av fruktfluen Drosophila , derav navnet deres (se History of Drosophila TRP -kanaler nedenfor). Senere ble TRP -kanaler funnet hos virveldyr der de er allestedsnærværende uttrykt i mange celletyper og vev. De fleste TRP-kanaler består av 6 membranspennende spiraler med intracellulære N- og C-terminaler . Pattedyrs TRP -kanaler aktiveres og reguleres av en rekke stimuli og uttrykkes i hele kroppen.
Familier
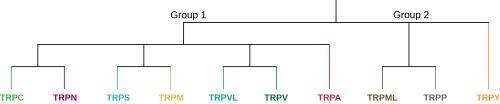
I dyre -TRP -superfamilien er det for tiden 9 foreslåtte familier delt inn i to grupper, hver familie inneholder et antall underfamilier. Gruppe én består av TRPC, TRPV, TRPVL, TRPA, TRPM, TRPS og TRPN, mens gruppe to inneholder TRPP og TRPML. Det er en ekstra familie merket TRPY som ikke alltid er inkludert i noen av disse gruppene. Alle disse underfamiliene er like ved at de er molekylære sansende, ikke-selektive kationskanaler som har seks transmembransegmenter, men hver underfamilie er veldig unik og deler lite strukturell homologi med hverandre. Denne særegenheten gir opphav til de forskjellige sensoriske oppfatnings- og reguleringsfunksjonene som TRP -kanaler har i hele kroppen. Gruppe én og gruppe to varierer ved at både TRPP og TRPML i gruppe to har en mye lengre ekstracellulær sløyfe mellom S1 og S2 transmembransegmentene. En annen differensierende egenskap er at alle gruppe-en-underfamiliene enten inneholder en C-terminal, intracellulær ankyrin-gjentagelsessekvens, en N-terminal TRP-domenesekvens eller begge deler-mens begge gruppe to underfamilier ikke har noen. Nedenfor er medlemmer av underfamiliene og en kort beskrivelse av hver:
TRPA
| Familie | Underfamilie | Kjent Taxa |
|---|---|---|
| TRPA | TRPA1 | Vertebrater , leddyr og bløtdyr |
| TRPA-aktig | Choanoflagellater , cnidarians , nematoder , leddyr (bare krepsdyr og myriapoder), bløtdyr og pighuder | |
| TRPA5 | Leddyr (bare krepsdyr og insekter) | |
| smertefri | ||
| feber | ||
| vannbryter | ||
| HsTRPA | Spesifikk for hymenopteranske insekter |
TRPA, A for "ankyrin", er oppkalt etter den store mengden ankyrin-gjentakelser som er funnet nær N-terminalen. TRPA finnes hovedsakelig i afferente nociceptive nervefibre og er assosiert med forsterkning av smertesignalering så vel som kald smerteoverfølsomhet. Disse kanalene har vist seg å være både mekaniske reseptorer for smerter og kjemosensorer aktivert av forskjellige kjemiske arter, inkludert isotiocyanater (skarpe kjemikalier i stoffer som sennepsolje og wasabi), cannabinoider, generelle og lokale analgetika og cinnamaldehyd.
Mens TRPA1 kommer til uttrykk hos et stort utvalg av dyr, eksisterer det en rekke andre TRPA -kanaler utenfor virveldyr. TRPA5, smertefri, pyreksi og vannbryter er forskjellige fylogenetiske grener i TRPA-kladen, og er bare vist å komme til uttrykk i krepsdyr og insekter, mens HsTRPA oppsto som en Hymenoptera-spesifikk duplisering av vannheks. I likhet med TRPA1 og andre TRP -kanaler fungerer disse som ionekanaler i en rekke sensoriske systemer. TRPA- eller TRPA1-lignende kanaler eksisterer også i en rekke arter som en fylogenetisk distinkt klade, men disse er mindre godt forstått.
TRPC
| Familie | Underfamilie | Kjent Taxa |
|---|---|---|
| TRPC | TRPC1 | Virveldyr |
| TRPC2 | ||
| TRPC3 | ||
| TRPC4 | ||
| TRPC5 | ||
| TRPC6 | ||
| TRPC7 | ||
| TRP | Leddyr | |
| TRPgamma | ||
| TRPL | ||
| Ukjent | Choanoflagellater, cnidarians, xenacoelomorphs , lophotrochozoans og nematoder |
TRPC, C for "kanonisk", er oppkalt etter å ha vært den mest beslektede med drosophilia TRP, navnebror til TRP -kanaler. Fylogenien til TRPC -kanaler er ikke løst i detalj, men de er tilstede på tvers av dyretaxa. Det er faktisk bare seks TRPC-kanaler uttrykt hos mennesker fordi TRPC2 bare er uttrykt i mus og regnes som et pseudo-gen hos mennesker; Dette skyldes delvis rollen som TRPC2 i påvisning av feromoner, som mus har en økt evne sammenlignet med mennesker. Mutasjoner i TRPC -kanaler har vært assosiert med luftveissykdommer sammen med fokal segmental glomerulosklerose i nyrene. Alle TRPC -kanaler aktiveres enten av fosfolipase C (PLC) eller diacyglyserol (DAG).
TRPM
| Familie | Underfamilie | Kjent Taxa |
|---|---|---|
| TRPM | Alpha/α (inkl. TRPM1, 3, 6 og 7) | Choanoflagellater og dyr (unntatt tardigrader ) |
| Beta/β (inkl. TRPM2, 4, 5 og 8) |
TRPM, M for "melastatin", ble funnet under en komparativ genetisk analyse mellom godartet nevi og ondartet nevi (melanom). Mutasjoner innenfor TRPM -kanaler har vært assosiert med hypomagnesemi med sekundær hypokalsemi. TRPM-kanaler har også blitt kjent for sine kaldfølende mekanismer, slik er tilfellet med TRPM8. Sammenlignende studier har vist at de funksjonelle domenene og de kritiske aminosyrene til TRPM -kanaler er sterkt konservert på tvers av arter.
Filogenetikk har vist at TRPM -kanaler er delt inn i to store klader, αTRPM og βTRPM. αTRPM inkluderer blant annet vertebrate TRPM1, TRPM3 og "chanzymes" TRPM6 og TRPM7, samt den eneste insekt TRPM -kanalen. βTRPM inkluderer, men er ikke begrenset til, virveldyr TRPM2, TRPM4, TRPM5 og TRPM8 (kald- og mentolsensoren). Ytterligere to større klader er beskrevet: TRPMc, som bare er tilstede i en rekke leddyr, og en basal klade, som siden har blitt foreslått å være en distinkt og separat TRP -kanalfamilie (TRPS).
TRPML
| Familie | Underfamilie | Kjent Taxa |
|---|---|---|
| TRPML | Ukjent | Cnidarians, basal vertebrater, tunikaer , cephalochordater , hemichordater , pighuder, leddyr og nematoder |
| TRPML1 | Spesifikk for kjevevirveldyr | |
| TRPML2 | ||
| TRPML3 |
TRPML, ML for "mucolipin", har navnet sitt fra nevroutviklingslidelsen mucolipidosis IV . Mucolipidosis IV ble først oppdaget i 1974 av ER Berman som la merke til abnormiteter i et spedbarns øyne. Disse abnormitetene ble snart assosiert med mutasjoner til MCOLN1 -genet som koder for TRPML1 -ionekanalen. TRPML er fremdeles ikke høyt karakterisert. De tre kjente vertebratkopiene er begrenset til kjevevirveldyr, med noen unntak (f.eks. Xenopus tropicalis ).
TRPN
| Familie | Underfamilie | Kjent Taxa |
|---|---|---|
| TRPN | TRPN/nompC | Placozoans, cnidarians, nematoder, leddyr, bløtdyr, annelider og virveldyr (unntatt fostervann) |
TRPN ble opprinnelig beskrevet i Drosophila melanogaster og Caenorhabditis elegans som nompC, en mekanisk lukket ionekanal. Bare en enkelt TRPN, N for "ingen mekanoreceptorpotensial C", eller "nompC", er kjent for å være bredt uttrykt hos dyr (selv om noen Cnidarians har mer), og er spesielt bare et pseudogen hos amniotevirveldyr . Til tross for at TRPA er oppkalt etter ankyrin -gjentakelser, antas det at TRPN -kanaler har mest mulig av enhver TRP -kanal, vanligvis rundt 28, som er sterkt bevart på tvers av taxa Siden oppdagelsen har Drosophila nompC vært implisert i mekanosensasjon (inkludert mekanisk stimulering av neglebåndet og lyddeteksjon) og kald nociception .
TRPP
| Familie | Underfamilie | Kjent Taxa |
|---|---|---|
| TRPP | PKD1-lignende | Dyr (unntatt leddyr) |
| PKD2-lignende | Dyr | |
| Brividos | Insekter |
TRPP , P for "polycistin", er oppkalt etter polycystisk nyresykdom , som er forbundet med disse kanalene. Disse kanalene blir også referert til som PKD (polycistic kindey disease) -ionkanaler.
PKD2-lignende gener (eksempler inkluderer TRPP2 , TRPP3 og TRPP5 ) koder for kanoniske TRP-kanaler. PKD1-lignende gener koder for mye større proteiner med 11 transmembransegmenter, som ikke har alle funksjonene til andre TRP-kanaler. Imidlertid har 6 av de transmebrane segmentene av PKD1-lignende proteiner betydelig sekvenshomologi med TRP-kanaler, noe som indikerer at de ganske enkelt kan ha diversifisert seg sterkt fra andre nært beslektede proteiner.
Insekter har en tredje underfamilie av TRPP, kalt brividos, som deltar i kald sensing.
TRPS
TRPS, S for Soromelastatin, ble oppkalt da det danner en søstergruppe til TRPM. TRPS er stort sett tilstede hos dyr, men er spesielt fraværende blant virveldyr og insekter (blant andre). TRPS har ennå ikke blitt godt beskrevet funksjonelt, selv om det er kjent at C. elegans TRPS, kjent som CED-11, er en kalsiumkanal som deltar i apoptose .
TRPV
| Familie | Underfamilie | Kjent Taxa |
|---|---|---|
| TRPV | Nanchung | Placozoans , cnidarians, nematoder, annelider, bløtdyr og leddyr (muligens unntatt edderkoppdyr ) |
| Inaktiv | ||
| TRPV1 | Spesifikk for virveldyr | |
| TRPV2 | ||
| TRPV3 | ||
| TRPV4 | ||
| TRPV5 | ||
| TRPV6 |
TRPV, V for "vanilloid", ble opprinnelig oppdaget i Caenorhabditis elegans , og er oppkalt etter vanilloidkjemikaliene som aktiverer noen av disse kanalene. Disse kanalene har blitt kjent for sin tilknytning til molekyler som capsaicin (en TRPV1 -agonist). I tillegg til de 6 kjente virveldyrparalogene, er 2 store klader kjent utenfor determostomene: nanchung og Iav. Mekanistiske studier av disse sistnevnte kladene har stort sett vært begrenset til Drosophila , men fylogenetiske analyser har plassert en rekke andre gener fra Placozoa, Annelida, Cnidaria, Mollusca og andre leddyr i dem. TRPV -kanaler er også beskrevet i protister.
TRPVL
TRPVL har blitt foreslått å være en søsterklade til TRPV, og er begrenset til cnidarians Nematostella vectensis og Hydra magnipapillata , og annelid Capitella teleta . Lite er kjent om disse kanalene.
TRPY
TRPY, Y for "gjær", er sterkt lokalisert til gjærvakuolen, som er den funksjonelle ekvivalenten til et lysosom i en pattedyrcelle, og fungerer som en mekanosensor for vakuolært osmotisk trykk. Patch clamp teknikker og hyperosmotisk stimulering har illustrert at TRPY spiller en rolle i intracellulær kalsiumfrigivelse. Fylogenetisk analyse har vist at TRPY1 ikke utgjør en del med de andre metazoanske TRP -gruppene en og to, og antydes å ha utviklet seg etter at metazoaner og sopp divergerer. Andre har indikert at TRPY er nærmere beslektet med TRPP.
Struktur
TRP-kanaler består av 6 membran- spennende helixer (S1-S6) med intracellulære N- og C-terminaler . Pattedyrs TRP-kanaler aktiveres og reguleres av en rekke stimuli, inkludert mange post-transkripsjonelle mekanismer som fosforylering , G-proteinreseptorkobling , ligand-gating og ubiquitination . Reseptorene finnes i nesten alle celletyper og er stort sett lokalisert i celle- og organellmembraner, noe som modulerer ioninngang.
De fleste TRP-kanaler danner homo- eller heterotetramere når de er fullstendig funksjonelle. Ionselektivitetsfilteret, pore, dannes av den komplekse kombinasjonen av p-sløyfer i det tetrameriske proteinet, som ligger i det ekstracellulære domenet mellom S5- og S6-transmembransegmentene. Som med de fleste katjonkanaler har TRP -kanaler negativt ladede rester i porene for å tiltrekke seg de positivt ladede ionene.
Gruppe 1 Kjennetegn
Hver kanal i denne gruppen er strukturelt unik, noe som øker mangfoldet av funksjoner som TRP -kanaler besitter, men det er noen fellestrekk som skiller denne gruppen fra andre. Fra den intracellulære N-terminalen er det varierende lengder på ankryin-repetisjoner (unntatt i TRPM) som hjelper til med membranforankring og andre proteininteraksjoner. Kort tid etter S6 på C-terminalenden er det et svært konservert TRP-domene (unntatt i TRPA) som er involvert i portmodulering og kanalmultimerisering. Andre C-terminale modifikasjoner som alfa-kinasedomener i TRPM7 og M8 er også sett i denne gruppen.
Gruppe 2 Kjennetegn
Gruppe to mest kjennetegnende trekk er det lange ekstracellulære spennet mellom S1 og S2 transmembransegmentene. Medlemmer av gruppe to mangler også ankryin -gjentakelser og et TRP -domene. De har imidlertid vist seg å ha endoplasmatisk retikulum (ER) retensjonssekvenser mot C-terminalenden som illustrerer mulige interaksjoner med ER.
Funksjon
TRP -kanaler modulerer drivkrefter for ioninngang og Ca 2+ og Mg 2+ transportmaskiner i plasmamembranen, der de fleste er plassert. TRP har viktige interaksjoner med andre proteiner og danner ofte signalkomplekser, hvis eksakte veier er ukjente. TRP -kanaler ble opprinnelig oppdaget i trp -mutantstammen til fruktfluen Drosophila som viste forbigående potensialhøyde som respons på lysstimuli og ble så kalt forbigående reseptorpotensialkanaler . TRPML -kanaler fungerer som intracellulære kalsiumfrigjøringskanaler og tjener dermed en viktig rolle i organelleregulering. Viktigere er det at mange av disse kanalene formidler en rekke sansninger som følelser av smerte, temperatur, forskjellige smaker, trykk og syn. I kroppen antas det at noen TRP -kanaler oppfører seg som mikroskopiske termometre og brukes hos dyr til å føle varmt eller kaldt. TRP fungerer som sensorer for osmotisk trykk , volum , strekk og vibrasjon . TRP har vist seg å ha komplekse flerdimensjonale roller i sensorisk signalering. Mange TRPer fungerer som intracellulære kalsiumfrigjøringskanaler.
Smerte og temperaturfølelse
TRP -ionekanaler omdanner energi til handlingspotensialer i somatosensoriske nociceptorer. Thermo-TRP-kanaler har et C-terminalt domene som er ansvarlig for termosensering og har et spesifikt utskiftbart område som lar dem føle temperaturstimuli som er knyttet til ligandreguleringsprosesser. Selv om de fleste TRP -kanaler moduleres av temperaturendringer, har noen en avgjørende rolle i temperatursensasjon. Det er minst 6 forskjellige Thermo-TRP-kanaler, og hver spiller en annen rolle. For eksempel gjelder TRPM8 mekanismer for å føle kulde, TRPV1 og TRPM3 bidrar til varme- og betennelsesfornemmelser, og TRPA1 muliggjør mange signalveier som sensorisk transduksjon, nociception , betennelse og oksidativt stress .
Smak
TRPM5 er involvert i smak signalisering av søt , bitter og umami smak ved å modulere signalveien i type II smak reseptor -celler. TRPM5 aktiveres av de søte glykosidene som finnes i stevia -planten .
Flere andre TRP -kanaler spiller en betydelig rolle i kjemosensering gjennom sensoriske nerveender i munnen som er uavhengige av smaksløkene. TRPA1 reagerer på sennepsolje ( allylisotiocyanat ), wasabi og kanel, TRPA1 og TRPV1 reagerer på hvitløk ( allicin ), TRPV1 reagerer på chilipepper ( capsaicin ), TRPM8 aktiveres av mentol , kamfer , peppermynte og kjølemidler; TRPV2 aktiveres av molekyler ( THC , CBD og CBN ) som finnes i marihuana.
TRP-lignende kanaler i insektsyn

De trp -mutant fruktfluer, som mangler en funksjonell kopi av trpl-genet, er karakterisert ved en transient respons på lys, i motsetning til vill-type fluer som viser en forlenget fotoreseptoren celle -aktivitet i respons på lys. En fjernt beslektet isoform av TRP-kanal, TRP-lignende kanal (TRPL), ble senere identifisert i Drosophila fotoreseptorer, hvor den uttrykkes på omtrent 10- til 20 ganger lavere nivåer enn TRP-protein. En mutant flue, trpl , ble deretter isolert. Bortsett fra strukturelle forskjeller, er TRP- og TRPL -kanalene forskjellige i kationpermeabilitet og farmakologiske egenskaper.
TRP/TRPL -kanaler er alene ansvarlige for depolarisering av insektfotoreseptorplasmamembranen som respons på lys. Når disse kanalene åpnes, lar de natrium og kalsium komme inn i cellen nedover konsentrasjonsgradienten, som depolariserer membranen. Variasjoner i lysintensitet påvirker det totale antallet åpne TRP/TRPL -kanaler, og dermed graden av membrandepolarisering. Disse gradert spenningsreaksjoner overføres til fotoreseptoren synapser med andre-ordens retinale nevroner og videre til hjernen.
Det er viktig å merke seg at mekanismen for insektfotosepsjon er dramatisk forskjellig fra den hos pattedyr. Eksitasjon av rhodopsin i pattedyrs fotoreseptorer fører til hyperpolarisering av reseptormembranen, men ikke til depolarisering som i insektøyet. I Drosophila og, antas det, andre insekter, kobler en fosfolipase C (PLC) -mediert signalkaskade fotoekscitasjon av rhodopsin til åpningen av TRP/TRPL-kanalene. Selv om mange aktivatorer av disse kanalene som fosfatidylinositol-4,5-bisfosfat (PIP 2 ) og flerumettede fettsyrer (PUFA) var kjent i årevis, var en nøkkelfaktor som medierer kjemisk kobling mellom PLC- og TRP/TRPL-kanaler et mysterium inntil nylig. Det ble funnet at nedbrytning av et lipidprodukt fra PLC -kaskade, diacylglyserol (DAG), ved enzymet diacylglycerol lipase , genererer PUFA som kan aktivere TRP -kanaler, og dermed starte membrandepolarisering som respons på lys. Denne mekanismen for aktivering av TRP-kanal kan være godt bevart blant andre celletyper der disse kanalene utfører forskjellige funksjoner.
Klinisk signifikans
Mutasjoner i trps har vært knyttet til neurodegenerative forstyrrelser, skjelett dysplasi , nyresykdommer, og kan spille en viktig rolle ved kreft. TRP kan gjøre viktige terapeutiske mål. Det er betydelig klinisk betydning for TRPV1, TRPV2, TRPV3 og TRPM8s rolle som termoreceptorer, og TRPV4 og TRPA1s rolle som mekanoreseptorer; reduksjon av kronisk smerte kan være mulig ved å målrette mot ionekanaler involvert i termisk, kjemisk og mekanisk følelse for å redusere følsomheten for stimuli. For eksempel vil bruk av TRPV1 -agonister potensielt hemme nociception ved TRPV1, spesielt i bukspyttkjertelvev der TRPV1 er sterkt uttrykt. TRPV1 -agonisten capsaicin, som finnes i chilipepper, har blitt indikert for å lindre nevropatisk smerte. TRPV1 -agonister hemmer nociception ved TRPV1
Rolle i kreft
Endret uttrykk for TRP -proteiner fører ofte til tumorigenese , som rapportert for TRPV1, TRPV6, TRPC1, TRPC6, TRPM4, TRPM5 og TRPM8. TRPV1 og TRPV2 har vært implisert i brystkreft. TRPV1 -uttrykk i aggregater funnet på endoplasmatisk retikulum eller Golgi -apparat og/eller rundt disse strukturene hos brystkreftpasienter gir dårligere overlevelse. TRPV2 er et potensielt biomarkør og terapeutisk mål for trippel negativ brystkreft. TRPM-familien av ionekanaler er spesielt assosiert med prostatakreft hvor TRPM2 (og dets lange ikke-kodende RNA TRPM2-AS ), TRPM4 og TRPM8 er overuttrykt i prostatakreft forbundet med mer aggressive utfall. TRPM3 har vist seg å fremme vekst og autofagi ved nyrecellekarsinom i klare celler, TRPM4 er overuttrykt i diffust stort B-cellelymfom assosiert med dårligere overlevelse, mens TRPM5 har onkogene egenskaper ved melanom .
Roll i inflammatoriske responser
I tillegg til TLR4 -medierte veier, gjenkjenner visse medlemmer av familien til de forbigående reseptorpotensielle ionekanalene LPS . LPS-mediert aktivering av TRPA1 ble vist hos mus og Drosophila melanogaster fluer. Ved høyere konsentrasjoner aktiverer LPS også andre medlemmer av den sensoriske TRP -kanalfamilien, for eksempel TRPV1, TRPM3 og til en viss grad TRPM8. LPS gjenkjennes av TRPV4 på epitelceller. TRPV4 -aktivering med LPS var nødvendig og tilstrekkelig for å indusere nitrogenoksidproduksjon med en bakteriedrepende effekt.
Historien om Drosophila TRP -kanaler
Den opprinnelige TRP-mutanten i Drosophila ble først beskrevet av Cosens og Manning i 1969 som "en mutant stamme av D. melanogaster som, selv om den oppfører seg fototaktisk positiv i en T-labyrint under svakt lys, er synshemmet og oppfører seg som blind" . Det viste også en unormal elektroretinogramrespons fra fotoreseptorer til lys som var forbigående snarere enn vedvarende som i "villtypen". Det ble senere undersøkt av Baruch Minke, en postdoktor i gruppen til William Pak, og navngitt TRP i henhold til dens oppførsel i ERG. Identiteten til det muterte proteinet var ukjent til det ble klonet av Craig Montell, en postdoktor i Gerald Rubins forskningsgruppe, i 1989, som noterte det forutsagte strukturelle forholdet til kanaler som var kjent på den tiden og Roger Hardie og Baruch Minke som ga bevis i 1992 for at det er en ionekanal som åpnes som respons på lysstimulering. TRPL -kanalen ble klonet og karakterisert i 1992 av forskergruppen til Leonard Kelly.
Referanser
Videre lesning
Eksterne linker
- Transient+Receptor+Potential+Channels at US National Library of Medicine Medical Subject Headings (MeSH)
- "Potensielle kanaler for forbigående reseptorer" . IUPHAR Database of Receptors and Ion Channels . International Union of Basic and Clinical Pharmacology.
- Clapham DE, DeCaen P, Carvacho I, Chaudhuri D, Doerner JF, Julius D, et al. "Potensielle kanaler for forbigående reseptor" . IUPHAR/BPS Guide to Pharmacology.
- "TRIP -database" . en manuelt kurert database over protein-protein-interaksjoner for TRP-kanaler fra pattedyr .