Goodpasture syndrom - Goodpasture syndrome
| Goodpasture syndrom | |
|---|---|
| Andre navn | Goodpastures sykdom, antiglomerulær kjellerantistoffsykdom, anti-GBM sykdom |
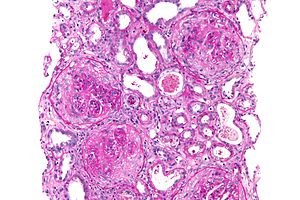 | |
| Mikrograf av en halvmåne glomerulonefrit som ble vist å være antiglomerulær basalmembransykdom, PAS -flekk | |
| Spesialitet |
Nefrologi , pulmonologi , immunologi |
Goodpasture syndrom (GPS) , også kjent som anti-glomerulær basalmembransykdom , er en sjelden autoimmun sykdom der antistoffer angriper kjellermembranen i lunger og nyrer, noe som fører til blødning fra lungene, glomerulonefrit og nyresvikt . Det antas å angripe alfa-3-underenheten av kollagen av type IV , som derfor har blitt referert til som Goodpastures antigen. Goodpasture syndrom kan raskt resultere i permanent lunge- og nyreskade, som ofte fører til døden. Det behandles med medisiner som undertrykker immunsystemet som kortikosteroider og cyklofosfamid , og med plasmaferese , der antistoffene fjernes fra blodet.
Sykdommen ble først beskrevet av en amerikansk patolog Ernest Goodpasture ved Vanderbilt University i 1919 og ble senere navngitt til hans ære.
Tegn og symptomer
Antistoffene mot glomerulær basalmembran (GBM) angriper først og fremst nyrene og lungene, selv om generelle symptomer som ubehag, vekttap, tretthet, feber og frysninger også er vanlige, i tillegg til smerter i ledd. 60 til 80% av de med tilstanden opplever både lunge- og nyreinnblanding; 20-40% har nyreengasjement alene, og mindre enn 10% har lungeinvolvering alene. Lungesymptomer vanligvis antedate nyresymptomer og inkluderer vanligvis: hoste opp blod , brystsmerter (i mindre enn 50% av tilfellene totalt sett), hoste og kortpustethet . Nyresymptomer inkluderer vanligvis blod i urinen , protein i urinen , uforklarlig hevelse i lemmer eller ansikt , store mengder urea i blodet og høyt blodtrykk .
Årsaken
Selv om den eksakte årsaken er ukjent, involverer den genetiske disposisjonen for GPS det humane leukocyttantigen (HLA) -systemet, spesielt HLA-DR15 . I tillegg til genetisk mottakelighet, er det nødvendig med en innledende miljømessig fornærmelse mot lungevaskulaturen for å la antiglomerulære basalmembranen (anti-GBM) antistoffer nå de alveolære kapillærene . Eksempler på en slik fornærmelse inkluderer: eksponering for organiske løsningsmidler (f.eks. Kloroform ) eller hydrokarboner, eksponering for tobakkrøyk , infeksjon (som influensa A ), innånding av kokain , metallstøvinhalering, bakteriemi , sepsis , miljø med mye oksygen og antilymfocyttterapier (spesielt med monoklonale antistoffer ). Eksponering for rensekjemikalier og ugressdrepende middel fra Paraquat har også blitt implisert som potensielle fornærmelser. I GPS produseres og sirkuleres anti-GBM-antistoffer gjennom blodet, noe som skader membranene som forer lungene og nyrene, og retter seg mot kapillærene.
Patofysiologi
GPS er forårsaket av unormal plasmacelleproduksjon av anti-GBM-antistoffer. Hovedmålet for disse unormale antistoffene er ikke-kollagen-domenet til alfa-3-kjeden av type 4-kollagen, som for det meste finnes i basalmembranene i glomerulære og alveolære kapillærer, og forklarer de uklart spesifikke symptomene på denne tilstanden. Disse antistoffene binder sine reaktive epitoper til kjellermembranene og aktiverer komplementkaskaden, noe som fører til døden til merkede celler. Et spesifikt antistoff og epitopbinding som viser den høyeste affinitet og er patogent, oppstår mellom GP A- antistoffer og anti-GBM-epitopregionen, betegnet E A , som er rester 17-31 av alfa 3-underenheten til ikke-kollagent domene av type IV kollagen. T -celler er også implisert, selv om det generelt sett regnes som en overfølsomhetsreaksjon av type II.
Diagnose
Diagnosen GPS er ofte vanskelig, ettersom mange andre sykdommer kan forårsake de forskjellige manifestasjonene av tilstanden, og selve tilstanden er sjelden. Den mest nøyaktige måten å oppnå diagnosen på er å teste det berørte vevet ved hjelp av en biopsi , spesielt nyrene, ettersom det er det best studerte organet for å få en prøve for tilstedeværelse av anti-GBM-antistoffer. På toppen av anti-GBM-antistoffene som er implisert i sykdommen, har omtrent en av tre av de berørte også cytoplasmatiske antineutrofile antistoffer i blodet, som ofte går foran anti-GBM-antistoffene med noen få måneder eller til og med år. Jo senere sykdommen blir diagnostisert, jo verre er utfallet for den berørte personen.
I tillegg, hvis det er betydelig mistanke om sykdommen, utføres vanligvis seralogisk testing for ELISA -analyse ved å lete etter alfa3 NC1 -domeneareal for kollagen IV for å unngå falske positiver.
Behandling
Den viktigste bærebjelken i behandlingen av GPS er plasmaferese , en prosedyre der den berørte persons blod sendes gjennom en sentrifuge og de forskjellige komponentene separeres basert på vekt. Den plasma inneholder anti-GBM-antistoffer som angriper den berørte personens lunger og nyrer, og blir filtrert ut. De andre delene av blodet (de røde blodlegemene , hvite blodlegemer og blodplater ) resirkuleres og injiseres intravenøst på nytt. De fleste individer som er rammet av sykdommen må også behandles med immunsuppressive legemidler, spesielt cyklofosfamid , prednison og rituximab , for å forhindre dannelse av nye anti-GBM- antistoffer for å forhindre ytterligere skade på nyrer og lunger. Andre, mindre giftige immunsuppressive midler som azatioprin kan brukes for å opprettholde remisjon.
Prognose
Ved behandling er den femårige overlevelsesraten> 80%, og færre enn 30% av de berørte individer krever langvarig dialyse. En studie utført i Australia og New Zealand viste at median overlevelsestid er 5,93 år hos pasienter som trenger nyrebehandling (inkludert dialyse). Uten behandling vil praktisk talt alle berørte personer dø av enten avansert nyresvikt eller lungeblødninger.
Epidemiologi
GPS er sjelden, og påvirker omtrent 0,5–1,8 per million mennesker per år i Europa og Asia. Det er også uvanlig blant autoimmune sykdommer ved at det er mer vanlig hos menn enn hos kvinner og også er mindre vanlig hos svarte enn hvite, men mer vanlig hos maori -folket i New Zealand. Høyeste aldersspenn for sykdomsutbruddet er 20–30 og 60–70 år.
Se også
Referanser
Eksterne linker
| Klassifisering | |
|---|---|
| Eksterne ressurser |