Hepatitt D - Hepatitis D
| Hepatitt D | |
|---|---|
| Andre navn | Hepatitt delta |
| Spesialitet | Gastroenterologi , smittsom sykdom |
| Symptomer | Trøtt, kvalme og oppkast |
| Komplikasjoner | Skrumplever |
| Årsaker | Hepatitt D -virus |
| Diagnostisk metode | Immunoglobulin G |
| Behandling | Antivirale midler, pegylert interferon alfa |
| Medisinering | Bulevirtide |
Hepatitt D er en type viral hepatitt forårsaket av hepatitt delta -virus ( HDV ). HDV er en av fem kjente hepatittvirus: A , B , C , D, og E . HDV regnes for å være en satellitt (en type subviralt middel ) fordi den bare kan spre seg i nærvær av hepatitt B -virus (HBV). Overføring av HDV kan skje enten via samtidig infeksjon med HBV ( koinfeksjon ) eller overlagt kronisk hepatitt B- eller hepatitt B -bærertilstand ( superinfeksjon ).
HDV og HBV som infiserer en person samtidig, regnes som den mest alvorlige typen viral hepatitt på grunn av alvorlighetsgraden av komplikasjoner. Disse komplikasjonene inkluderer større sannsynlighet for å oppleve leversvikt ved akutte infeksjoner og en rask progresjon til levercirrhose , med økt risiko for å utvikle leverkreft ved kroniske infeksjoner. I kombinasjon med hepatitt B -virus har hepatitt D den høyeste dødeligheten av alle hepatittinfeksjoner, med 20%. Et nylig estimat fra 2020 antyder at for tiden er 48 millioner mennesker smittet med dette viruset.
Virologi
| Hepatitt delta -virus | |
|---|---|
|
|
| Skjematisk fremstilling av hepatitt delta -virusvirion | |
|
Virusklassifisering |
|
| (uten rangering): | Virus |
| Rike : | Ribozyviria |
| Familie: | Kolmioviridae |
| Slekt: | Deltavirus |
| Arter | |
|
|
Struktur og genom
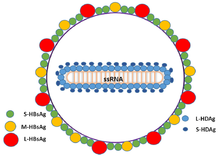
Den hepatitt delta virus eller HDV, er åtte arter av negativ-sense enkelt-trådete RNA- virus (eller virus-lignende partikler) klassifisert som sammen slekten Deltavirus , innenfor området Ribozyviria . HDV virion er en liten, sfærisk, innhyllet partikkel med en diameter på 36 nm; dets virale konvolutt inneholder vertsfosfolipider, samt tre proteiner hentet fra hepatitt B -viruset - de store, mellomstore og små hepatitt B -overflateantigenene. Denne forsamlingen omgir en indre ribonukleoprotein (RNP) partikkel, som inneholder genomet omgitt av omtrent 200 molekyler hepatitt D -antigen (HDAg) for hvert genom. Den sentrale regionen av HDAg har vist seg å binde RNA. Flere interaksjoner formidles også av en spole-spole- region ved N-enden av HDAg.
HDV-genomet er negativ sans , enkeltstrenget, lukket sirkulært RNA ; med et genom på omtrent 1700 nukleotider, er HDV det minste "viruset" som er kjent for å infisere dyr. Det har blitt foreslått at HDV kan ha sin opprinnelse fra en klasse av plantepatogener kalt viroider , som er mye mindre enn virus. Genomet er unikt blant dyrevirus på grunn av det høye GC -nukleotidinnholdet. Nukleotidsekvensen er omtrent 70% selvkomplementær, slik at genomet kan danne en delvis dobbeltstrenget, stavlignende RNA-struktur. HDV -stammer er svært divergerende; fusjoner av forskjellige stammer eksisterer og sekvenser hadde blitt deponert i offentlige databaser som bruker forskjellige startsteder for det sirkulære virale DNA som er involvert. Dette hadde resultert i noe kaos med hensyn til molekylær klassifisering av dette viruset, en situasjon som nylig har blitt løst med vedtakelsen av et foreslått referansegenom og et enhetlig klassifiseringssystem.
Livssyklus
I likhet med hepatitt B, får HDV adgang til leverceller via NTCP -galletransportøren . HDV gjenkjenner sin reseptor via det N-terminale domenet til det store hepatitt B-overflateantigenet, HBsAg . Kartlegging ved mutagenese av dette domenet har vist at aminosyrerester 9–15 utgjør reseptorbindingsstedet. Etter å ha kommet inn i hepatocytten, er viruset ubelagt og nukleokapsidet translokert til kjernen på grunn av et signal i HDAg Siden HDV -genomet ikke koder for en RNA -polymerase for å replikere virusets genom, bruker viruset verts -cellulære RNA -polymeraser . Opprinnelig tenkt å bare bruke RNA -polymerase II, nå har RNA -polymeraser I og III også vist seg å være involvert i HDV -replikasjon. Normalt bruker RNA -polymerase II DNA som en mal og produserer mRNA. Følgelig, hvis HDV virkelig bruker RNA-polymerase II under replikasjon, ville det være det eneste kjente dyrepatogenet som er i stand til å bruke en DNA-avhengig polymerase som en RNA-avhengig polymerase.
RNA-polymerasene behandler RNA-genomet som dobbeltstrenget DNA på grunn av den brettede stavlignende strukturen det er i. Tre former for RNA lages; sirkulært genomisk RNA, sirkulært komplementært antigenomisk RNA og et lineært polyadenylert antigenomisk RNA, som er mRNA som inneholder den åpne leserammen for HDAg. Syntese av antigenomisk RNA skjer i nucleolus, mediert av RNA -polymerase I, mens syntese av genomisk RNA finner sted i nukleoplasma, mediert av RNA -polymerase II. HDV RNA syntetiseres først som lineært RNA som inneholder mange kopier av genomet. Det genomiske og antigenomiske RNA inneholder en sekvens på 85 nukleotider, hepatitt delta-virus-ribozym , som fungerer som et ribozym , som selv kløver det lineære RNA til monomerer. Disse monomerer blir deretter ligert for å danne sirkulært RNA.
Delta antigener
| Hepatitt delta virus delta antigen | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 oligomeriseringsdomene for hepatitt delta -antigen
| |||||||||
| Identifikatorer | |||||||||
| Symbol | HDV_ag | ||||||||
| Pfam | PF01517 | ||||||||
| InterPro | IPR002506 | ||||||||
| SCOP2 | 1a92 / SCOPe / SUPFAM | ||||||||
| |||||||||
En signifikant forskjell mellom viroider og HDV er at mens viroider ikke produserer proteiner, er det kjent at HDV produserer ett protein, nemlig HDAg. Den kommer i to former; en 27kDa stor-HDAg, og en liten-HDAg på 24kDa. N-terminalene til de to formene er identiske, de skiller seg med 19 flere aminosyrer i C-terminalen til det store HDAg. Begge isoformer er produsert fra den samme leserammen som inneholder et UAG-stoppkodon ved kodon 196, som normalt bare produserer det lille HDAg. Redigering av cellulært enzym adenosindeaminase-1 endrer imidlertid stoppkodonet til UGG, slik at det store HDAg kan produseres. Til tross for at de har 90% identiske sekvenser, spiller disse to proteinene divergerende roller i løpet av en infeksjon. HDAg-S produseres i de tidlige stadiene av en infeksjon og kommer inn i kjernen og støtter viral replikasjon. HDAg-L, derimot, produseres i de senere stadiene av en infeksjon, fungerer som en hemmer av viral replikasjon og er nødvendig for montering av viruspartikler. Således er RNA -redigering av cellulære enzymer avgjørende for virusets livssyklus fordi den regulerer balansen mellom viral replikasjon og virionmontering.
Antigen sløyfe
HDV -konvoluttproteinet har tre av HBV -overflateproteinene forankret til det. S -regionen i genomet uttrykkes oftest, og hovedfunksjonen er å samle subvirale partikler. HDV-antigenproteiner kombineres med virusgenomet for å danne et ribonukleoprotein (RNP) som når de er innhyllet med subvirale partikler kan danne viruslignende partikler som er nesten identiske med modent HDV, men de er ikke smittsomme. Forskere hadde konkludert med at determinanten for smittsomhet av HDV var innenfor det N-terminale pre-S1-domenet til det store proteinet (L). Det ble funnet å være en mediator i binding til mobilreseptoren. Forskerne Georges Abou Jaoudé og Camille Sureau publiserte en artikkel i 2005 som studerte rollen til den antigene sløyfen, som finnes i HDV -konvoluttproteiner, i virusets smittsomhet. Den antigene sløyfe, i likhet med det N-terminale pre-S1-domenet til det store proteinet, blir avslørt ved virionoverflaten. Studien til Jaoudé og Sureau ga bevis på at den antigene sløyfen kan være en viktig faktor for HDV -inntreden i vertscellen, og ved å mutere deler av den antigene sløyfen, kan infektiviteten til HDV minimeres.
Overføring
Overføringsveiene for hepatitt D ligner de for hepatitt B. Infeksjon er i stor grad begrenset til personer med høy risiko for hepatitt B -infeksjon, spesielt injiserende rusmisbrukere og personer som får koagulasjonsfaktorkonsentrater. På verdensbasis er mer enn 15 millioner mennesker co-smittet. HDV er sjelden i de fleste utviklede land , og er hovedsakelig forbundet med intravenøs bruk av medisiner . HDV er imidlertid mye mer vanlig i den umiddelbare Middelhavsregionen, Afrika sør for Sahara, Midtøsten og den nordlige delen av Sør-Amerika. Totalt kan rundt 20 millioner mennesker være smittet med HDV.
Forebygging
Vaksinen mot hepatitt B beskytter mot hepatitt D -virus på grunn av sistnevntes avhengighet av tilstedeværelsen av hepatitt B -virus for at det skal replikere.
I mangel av en spesifikk vaksine mot deltavirus, må vaksinen mot HBV gis kort tid etter fødselen i risikogrupper .
Behandling
Hepatitt D regnes generelt som det dominerende viruset over hepatitt B, bortsett fra i sjeldne tilfeller. Gjeldende etablerte behandlinger for kronisk hepatitt D inkluderer konvensjonell eller pegylert interferon alfa -behandling. Siste bevis tyder på at pegylert interferon alfa er effektivt for å redusere virusmengden og effekten av sykdommen i løpet av tiden legemidlet gis, men fordelen stopper vanligvis hvis legemidlet avbrytes. Effektiviteten av denne behandlingen overstiger vanligvis ikke ~ 20%, og sent tilbakefall etter behandling er rapportert.
I mai 2020 godkjente komiteen for legemidler for mennesker ved European Medicines Agency det antivirale Hepcludex ( bulevirtide ) for å behandle hepatitt D og B. Bulevirtide binder og inaktiverer natrium/gallsyretransportøren , og blokkerer begge virusene fra å komme inn i hepatocytter .
Epidemiologi

De som rammes er individer som har blitt smittet med hepatitt B -virus ettersom hepatitt D (HDV) -viruset trenger HBsAg (hepatitt B -overflateantigen) for emballering og overføring. Sykdommen er til stede over hele verden. Infeksjon med HDV er en stor medisinsk plage i lavinntektsregioner i verden der HBV fortsatt er endemisk. Det er derfor mest utbredt i land der HBV -infeksjon også er vanlig, for tiden Amazonasbassenget og lavinntektsregionene i Asia og Afrika. Forbedrede tiltak for å kontrollere HBV i industriland (for eksempel ved vaksinasjon) har også redusert forekomsten av HDV, med de største gjenværende risikopopulasjonene i de landene som er injeksjonsmisbrukere og immigranter fra endemiske HDV-områder.
Historie
Hepatitt D -virus ble først rapportert i 1977 som et atomantigen hos pasienter smittet med HBV som hadde alvorlig leversykdom. Dette atomantigenet ble da antatt å være et hepatitt B -antigen og ble kalt delta -antigenet. Senere eksperimenter med sjimpanser viste at hepatitt delta -antigenet (HDAg) var en strukturell del av et patogen som krevde HBV -infeksjon for å produsere en komplett viruspartikkel. Hele genomet ble klonet og sekvensert i 1986. Det ble deretter plassert i sin egen slekt: Deltavirus .
Lábrea feber
| Lábrea feber | |
|---|---|
| Andre navn | Lábrea's svart feber, Lábrea hepatitt, Santa Marta feber |
| Spesialitet | Infeksjonssykdom |
| Vanlig start | plutselig |
| Varighet | ca. 1 uke |
| Forebygging | HBV -vaksinasjon |
| Prognose | død |
Lábrea -feber er en dødelig tropisk infeksjon som ble oppdaget på 1950 -tallet i byen Lábrea , i det brasilianske Amazonas -bassenget , hvor den forekommer mest i området sør for Amazonas -elven, i delstatene Acre , Amazonas og Rondônia . Sykdommen har også blitt diagnostisert i Colombia og Peru. Det er nå kjent å være en coinfeksjon eller superinfeksjon av hepatitt B (HBV) med hepatitt D.
Lábrea -feber begynner plutselig med gulsott , anoreksi (mangel på matlyst), hematemese ( oppkast av blod), hodepine , feber og alvorlig nedstigning . Døden oppstår ved akutt leversvikt (ALF). I den siste fasen dukker det vanligvis opp nevrologiske symptomer som agitasjon, delirium , kramper og hemoragisk koma . Disse symptomene oppstår fra en fulminant hepatitt som kan drepe på mindre enn en uke, og som karakteristisk påvirker barn og unge voksne, og flere menn enn kvinner. Det ledsages også av encefalitt i mange tilfeller. Sykdommen er svært dødelig: i en studie utført i 1986 ved Boca do Acre , også i Amazonas, døde 39 pasienter av 44 i den akutte fasen av sykdommen. Overlevende kan utvikle kronisk sykdom.
Hovedoppdagelsen av delta -virus og HBV -forening ble gjort av Gilberta Bensabath , ved Instituto Evandro Chagas , i Belém , delstaten Pará , og hennes samarbeidspartnere.
Infiserte pasienter viser omfattende ødeleggelse av levervev , med steatose av en bestemt type (mikrosteatose, preget av små fettdråper inne i cellene), og infiltrasjon av et stort antall inflammatoriske celler kalt morula -celler , hovedsakelig bestående av makrofager som inneholder delta -virusantigener .
I Boca do Acre -studien fra 1987 gjorde forskere en epidemiologisk undersøkelse og rapporterte deltavirusinfeksjon hos 24% av asymptomatiske HBV -bærere, 29% av akutte ikke -minant hepatitt B -tilfeller, 74% av fulminante hepatitt B -tilfeller og 100% av kronisk hepatitt B saker. Deltaviruset ser ut til å være endemisk i Amazonas -regionen.
Utvikling
Tre genotyper (I – III) ble opprinnelig beskrevet. Genotype I har blitt isolert i Europa, Nord -Amerika, Afrika og noen Asia. Genotype II er funnet i Japan, Taiwan og Yakutia (Russland). Genotype III har blitt funnet utelukkende i Sør -Amerika (Peru, Colombia og Venezuela). Noen genomer fra Taiwan og Okinawa-øyene har vært vanskelige å skrive, men har blitt plassert i genotype 2. Imidlertid er det nå kjent at det er minst 8 genotyper av dette viruset (HDV-1 til HDV-8). Fylogenetiske studier tyder på en afrikansk opprinnelse for dette patogenet.
En analyse av 36 stammer av genotype 3 anslår at den siste vanlige stamfaren til disse stammene oppsto rundt 1930. Denne genotypen spredte seg eksponensielt fra begynnelsen av 1950 -årene til 1970 -årene i Sør -Amerika. Substitusjonsraten ble estimert til å være 1,07 × 10 −3 substitusjoner per område per år. En annen studie fant en generell evolusjonshastighet på 3,18 x 10 × 10 −3 substitusjoner per nettsted per år. Mutasjonshastigheten varierte med posisjon: den hypervariable regionen utviklet seg raskere (4,55 x 10 × 10 −3 substitusjoner per sted per år) enn hepatitt delta antigen kodende region (2,60 x 10 × 10 −3 substitusjoner per sted per år) og autokatalytisk region (1,11 x 10 × 10 −3 substitusjoner per nettsted per år). En tredje studie antydet en mutasjonsrate mellom 9,5x10 × 10 −3 til 1,2x10 × 10 −3 substitusjoner/sted/år.
Genotyper, med unntak av type 1, ser ut til å være begrenset til visse geografiske områder: HDV-2 (tidligere HDV-IIa) finnes i Japan, Taiwan og Yakutia; HDV-4 (tidligere HDV-IIb) i Japan og Taiwan; HDV-3 i Amazonas-regionen; HDV-5, HDV-6, HDV-7 og HDV-8 i Afrika. Genotype 8 har også blitt isolert fra Sør -Amerika. Denne genotypen finnes vanligvis bare i Afrika og kan ha blitt importert til Sør -Amerika under slavehandelen.
HDV-spesifikke CD8+ T-celler kan kontrollere viruset, men det har blitt funnet at HDV-mutasjoner unnslipper deteksjon av CD8+ T-celler.
Relaterte arter
Noen få andre virus med likhet med HDV har blitt beskrevet hos andre arter enn mennesker. I motsetning til HDV er ingen av dem avhengige av et Hepadnaviridae (HBV -familie) virus for å replikere. Disse midlene har stavlignende struktur, et delta-antigen og et ribozym. HDV og alle slike slektninger er klassifisert i sitt eget rike , Ribozyviria , av International Committee on Taxonomy of Viruses .
Referanser
Bibliografi
- Specter SC, red. (1999). Viral hepatitt: Diagnose, terapi og forebygging . Humana Press. ISBN 0-89603-424-0.
- da Fonseca JC (2004). "[Hepatitt fulminant i brasiliansk Amazon]" . Revista da Sociedade Brasileira de Medicina Tropical . 37. 37 Suppl 2: 93–5. doi : 10.1590/s0037-86822004000700015 . PMID 15586904 .
- Bensabath G, Soares M (2004). "[Utviklingen av kunnskap om viral hepatitt i Amazonas -regionen: fra epidemiologi og etiologi til profylaksen]" . Revista da Sociedade Brasileira de Medicina Tropical . 37 () Suppl 2): 14–26. doi : 10.1590/S0037-86822004000700003 . PMID 15586892 .
- Fonseca JC, Souza RA, Brasil LM, Araújo JR, Ferreira LC (2004). "Fulminant leversvikt hos barn og ungdom i Nord -Brasil" . Revista da Sociedade Brasileira de Medicina Tropical . 37 (1): 67–9. doi : 10.1590/S0037-86822004000100019 . PMID 15042190 .
Eksterne linker
- Verdens helseorganisasjons faktaark om hepatitt D
- ICTV -rapport : Deltavirus
- Viralzone : Deltavirus
- " Hepatitt delta -virus " . NCBI Taxonomy Browser . 12475.
| Klassifisering |
|---|
