Subventrikulær sone - Subventricular zone
| Subventrikulær sone | |
|---|---|
| Identifikatorer | |
| NeuroLex ID | nlx_144262 |
| Anatomiske termer for neuroanatomi | |

Den subventrikulære sonen ( SVZ ) er en region som ligger på ytterveggen til hver laterale ventrikkel i virveldyrhjernen . Det er tilstede i både den embryonale og voksne hjernen. I embryonalt liv refererer SVZ til en sekundær proliferativ sone som inneholder nevrale stamceller , som deler seg for å produsere nevroner i prosessen med nevrogenese . De primære nevrale stamcellene i hjernen og ryggmargen, kalt radiale glialceller , ligger i stedet i ventrikkelsonen (VZ) (såkalt fordi VZ strekker innsiden av de utviklende ventriklene ).
I den utviklende hjernebarken , som ligger i dorsal telencephalon , er SVZ og VZ forbigående vev som ikke eksisterer hos den voksne. SVZ av det ventrale telencephalon vedvarer imidlertid gjennom livet. Den voksne SVZ består av fire forskjellige lag med variabel tykkelse og celletetthet samt cellesammensetning. Sammen med dentate gyrus i hippocampus er SVZ et av to steder der det er funnet at neurogenese forekommer i den voksne pattedyrhjernen. Voksen SVZ -neurogenese har form av neuroblast -forløpere til interneuroner som migrerer til luktpæren gjennom rostral migreringsstrøm . SVZ ser også ut til å være involvert i generering av astrocytter etter en hjerneskade.
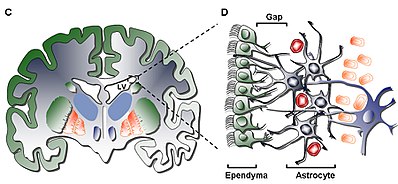
Struktur
Lag I
Det innerste laget (lag I) inneholder et enkelt lag (monolag) av ependymale celler som forer ventrikkelhulen; disse cellene har apikale cilia og flere basale ekspansjoner som kan stå parallelt eller vinkelrett på ventrikkeloverflaten. Disse utvidelsene kan interagere intimt med de astrocytiske prosessene som er forbundet med det hypocellulære laget (lag II).
Lag II
Det sekundære laget (Layer II) sørger for et hypocellulært gap som grenser til det tidligere, og har vist seg å inneholde et nettverk av funksjonelt korrelerte Glial Fibrillary Acid Protein ( GFAP ) -positive astrocytiske prosesser som er knyttet til overgangskomplekser, men mangler cellelegemer bortsett fra den sjeldne neuronale somata. Selv om funksjonen til dette laget ennå ikke er ukjent hos mennesker, har det blitt antatt at de astrocytiske og ependymale sammenkoblingene av lag I og II kan virke for å regulere nevronfunksjoner, etablere metabolsk homeostase og/eller kontrollere spredning og differensiering av neuronale stamceller under utvikling . Potensielt kan slike egenskaper ved laget fungere som en rest av det tidlige utviklingslivet eller veien for mobil migrasjon gitt likhet med et homologt lag i storfe SVZ vist å ha trekkceller som bare er felles for pattedyr av høyere orden.
Lag III
Det tredje laget (lag III) danner et bånd av astrocytcellelegemer som antas å opprettholde en subpopulasjon av astrocytter som er i stand til å spre seg in vivo og danne multipotente nevrosfærer med selvfornyelse evner in vitro. Selv om det er funnet noen oligodendrocytter og ependymale celler i båndet, tjener de ikke bare en ukjent funksjon, de er uvanlige sammenlignet med populasjonen av astrocytter som befinner seg i laget. Den astrocytter til stede i lag III kan deles inn i tre populasjonene ved elektronmikroskopi , og ingen unike funksjoner ennå gjenkjennbare; den første typen er en liten astrocytt av lange, horisontale, tangensielle projeksjoner som for det meste finnes i Layer II; den andre typen finnes mellom lag II og III, så vel som innenfor astrocytbåndet, preget av sin store størrelse og mange organeller; den tredje typen finnes vanligvis i de laterale ventriklene like over hippocampus og er omtrent like stor som den andre typen, men inneholder få organeller.
Lag IV
Den fjerde og siste (Layer IV) tjener som en overgangssone mellom Layer III med sin bånd av astrocytter og hjernen parenchyma . Det identifiseres ved høy tilstedeværelse av myelin i regionen.
Celletyper
Fire celletyper er beskrevet i SVZ:
1. Ciliated Ependymal Cells (Type E): er plassert vendt mot lumen i ventrikelen, og fungerer for å sirkulere cerebrospinalvæsken .
2. Spredning av neuroblaster (type A): ekspress PSA-NCAM ( NCAM1 ), Tuj1 ( TUBB3 ) og Hu, og migrer i linje rekkefølge til olfaktorisk pære
3. Sakte prolifererende celler (type B): uttrykk Nestin og GFAP , og funksjon for å skjule migrerende type A -neuroblaster
4. Aktivt spredende celler eller transittforsterkende progenitorer (type C): uttrykk Nestin, og danne klynger mellom hverandre mellom kjeder i hele regionen
Funksjon
SVZ er et kjent sted for nevrogenese og selvfornyende nevroner i den voksne hjernen , som fungerer som sådan på grunn av de interagerende celletypene, ekstracellulære molekyler og lokalisert epigenetisk regulering som fremmer slik cellulær spredning. Sammen med den subgranulære sonen til dentate gyrus , fungerer den subventrikulære sonen som en kilde til nevrale stamceller (NSC) i prosessen med voksen nevrogenese . Den har den største populasjonen av prolifererende celler i den voksne hjernen til gnagere, aper og mennesker. I 2010 ble det vist at balansen mellom nevrale stamceller og nevrale stamceller (NPC) opprettholdes av et samspill mellom den epidermale vekstfaktorreseptorsignalveien og Notch -signalveien.
Selv om den ennå ikke har blitt studert grundig i den menneskelige hjernen, har SVZ-funksjonen i gnagerehjernen til en viss grad blitt undersøkt og definert for sine evner. Med slik forskning har det blitt funnet at den dobbeltfungerende astrocyten er den dominerende cellen i gnageren SVZ; denne astrocyt fungerer ikke bare som en nevronal stamcelle, men også som en støttende celle som fremmer nevrogenese gjennom interaksjon med andre celler. Denne funksjonen induseres også av mikroglia og endotelceller som samhandler med neuronale stamceller for å fremme nevrogenese in vitro, samt ekstracellulære matrikskomponenter som tenascin-C (hjelper til med å definere grenser for interaksjon) og Lewis X (binder vekst- og signalfaktorer til nevrale forløpere). Den menneskelige SVZ er imidlertid forskjellig fra gnageren SVZ på to forskjellige måter; den første er at astrocyttene til mennesker ikke er i umiddelbar nærhet til det ependymale laget, snarere adskilt av et lag som mangler cellelegemer; den andre er at den menneskelige SVZ mangler kjeder av migrerende nevroblaster sett hos gnagere SVZ, noe som igjen gir et mindre antall nevronceller i mennesket enn gnageren. Av denne grunn, mens gnagere SVZ viser seg som en verdifull informasjonskilde om SVZ og dets struktur-til-funksjon-forhold, vil den menneskelige modellen vise seg vesentlig annerledes.
Epigenetiske DNA -modifikasjoner har en sentral rolle i regulering av genuttrykk under differensiering av nevrale stamceller . Konvertering av cytosin til 5-metylcytosin (5mC) i DNA med DNA-metyltransferase DNMT3A ser ut til å være en viktig type epigenetisk modifikasjon som forekommer i SVZ.
I tillegg foreslår noen nåværende teorier at SVZ også kan tjene som et sted for spredning for stamceller i hjernesvulst (BTSC), som ligner på nevrale stamceller i deres struktur og evne til å differensiere til nevroner , astrocytter og oligodendrocytter . Studier har bekreftet at en liten populasjon av BTSC ikke bare kan produsere svulster, men de kan også opprettholde den gjennom medfødt selvfornyelse og multipotente evner. Selv om dette ikke tillater slutning om at BTSC oppstår fra nevrale stamceller, reiser det et interessant spørsmål om forholdet som eksisterer fra våre egne celler til de som kan forårsake så mye skade.
Aktuell forskning
Det er for tiden mange forskjellige aspekter ved SVZ som forskes på enkeltpersoner i offentlig og privat sektor. Slike forskningsinteresser spenner fra SVZs rolle i nevrogenese , rettet neuronal migrasjon, til den tidligere nevnte tumorigenesen , så vel som mange andre. Nedenfor er det oppsummeringer av arbeidet til tre forskjellige laboratoriegrupper som hovedsakelig fokuserer på ett aspekt av SVZ; disse inkluderer SVZs rolle i celleerstatning etter hjerneskade, simulering av NSC -spredning og rolle i ulike tumorigene kreftformer.
Rollen i celleerstatning etter hjerneskade
I sin anmeldelse, Romanko et al. preget virkningen av akutt hjerneskade på SVZ. Samlet sett bestemte forfatterne at moderate fornærmelser mot SVZ tillot gjenoppretting mens mer alvorlige skader forårsaket permanent skade på regionen. I tillegg er den nevrale stamcellepopulasjonen i SVZ sannsynligvis ansvarlig for denne skaderesponsen.
Effekten av bestråling på SVZ sørget for en anerkjennelse av mengden eller dosen av stråling som kan gis, bestemmes hovedsakelig av toleransen til de normale cellene i nærheten av svulsten . Som beskrevet, den økende dose av stråling og alder førte til reduksjon i tre celletyper i SVZ, men ble observert reparasjon kapasiteten i SVZ tross for manglende hvit substans nekrose ; dette skjedde sannsynligvis fordi SVZ gradvis var i stand til å erstatte neuroglia i hjernen. Kjemoterapeutika ble også testet for deres effekt på SVZ, ettersom de for tiden brukes mot mange sykdommer, men som likevel fører til komplikasjoner i sentralnervesystemet . For å gjøre dette ble metotreksat (MTX) brukt alene og i kombinasjon med stråling for å finne ut at omtrent 70% av den totale atomtettheten til SVZ var utarmet, men gitt tap av neuroblastceller ( stamceller ), var det bemerkelsesverdig å finne at SVZ NSC fortsatt ville generere nevrokuler som ligner på personer som ikke mottok slik behandling. I forhold til avbrudd i blodtilførselen til hjernen, ble det funnet at cerebral hypoksi / iskemi (H / I) også reduserte celletallet til SVZ med 20%, med 50% av nevroner i striatum og neocortex som ble ødelagt, men celletyper av SVZ drept var like uuniform som selve regionen. Ved påfølgende testing ble det funnet at en annen del av hver celle ble eliminert, men den mediale SVZ -cellepopulasjonen forble for det meste i live. Dette kan sørge for en viss spenstighet for slike celler, med de uengasjerte stamcellene som fungerer som den prolifererende populasjonen etter iskemi . Mekanisk hjerneskade induserer også cellemigrasjon og spredning, slik det ble observert hos gnagere, og det kan også øke celletallet, og negere den tidligere oppfatningen om at ingen nye nevronceller kan genereres.
Avslutningsvis var denne gruppen i stand til å fastslå at celler i SVZ er i stand til å produsere nye nevroner og glia gjennom livet, ettersom den ikke lider skade, siden den er følsom for skadelige effekter. Derfor kan SVZ gjenopprette seg selv etter mild skade, og potensielt sørge for erstatningscellebehandling til andre berørte områder av hjernen.
Neuropeptid Ys rolle i nevrogenese
I et forsøk på å karakterisere og analysere mekanismen for spredning av nevronceller i den subventrikulære sonen, sier Decressac et al. observert spredning av nevrale forløpere i musens subventrikulære sone gjennom injeksjon av nevropeptidet Y (NPY). NPY er et vanligvis uttrykt protein i sentralnervesystemet som tidligere har vist seg å stimulere spredning av nevronceller i olfaktorisk epitel og hippocampus . Den peptid- s effekter ble observert gjennom BrdU- merking og celle fenotyping som ga bevis for migrering av neuroblasts gjennom den rostrale vandrende strøm til luktelappen (bekrefter tidligere eksperimenter) og til striatum . Slike data støtter forfatterens hypotese ved at nevrogenese ville bli stimulert gjennom introduksjon av et slikt peptid .
Som NPY er et 36 aminosyre -peptid forbundet med mange fysiologiske og patologiske tilstander, er det flere reseptorer som er bredt uttrykt i den utviklende og moden gnagerhjerne. Imidlertid, gitt in vivo -studier utført av denne gruppen, viste Y1 -reseptoren spesifikt mediert neuroproliferative effekter gjennom induksjon av NPY med økt ekspresjon i subventrikulær sone. Identifisering av Y1 -reseptoren kaster også lys over det faktum at fenotypen til uttrykte celler fra slike mitotiske hendelser faktisk er celler som er DCX + ( neuroblaster som migrerer direkte til striatum ). Sammen med effekten av NPY -injeksjon på striatal dopamin , GABA og glutamatparametere for å regulere nevrogenese i den subventrikulære sonen (tidligere studie), er dette funnet fortsatt under vurdering, ettersom det kan være en sekundær modulator av nevnte nevrotransmittere .
Som nødvendig for all forskning, gjennomførte denne gruppen sine eksperimenter med et bredt perspektiv på anvendelsen av funnene deres, som de hevdet potensielt kunne være til nytte for potensielle kandidater for endogen hjerne reparasjon gjennom stimulering av subventrikulær sone nevral stamcelle spredning. Denne naturlige molekylære reguleringen av voksen nevrogenese vil være et supplement til terapier av passende molekyler som den testede NPY- og Y1 -reseptoren, i tillegg til farmakologiske derivater, for å sørge for håndterbare former for nevrodegenerative lidelser i striatalområdet.
Som en potensiell kilde til hjernesvulster
I et forsøk på å karakterisere rollen til den subventrikulære sonen i potensiell tumorigenese , Quinones-Hinojosa et al. fant ut at hjernetumor stamceller (BTSC) er stamceller som kan isoleres fra hjernesvulster ved lignende analyser som brukes for nevronale stamceller. Ved dannelsen av klonale sfærer som ligner på nevrokuler i nevronale stamceller, var disse BTSCene i stand til å differensiere til nevroner , astrocytter og oligodendrocytter in vitro , men enda viktigere i stand til å starte svulster ved lave cellekonsentrasjoner, noe som gir en selvfornyelseskapasitet. Det ble derfor foreslått at en liten populasjon av BTSC med slike selvfornyelsesevner opprettholder svulster ved sykdommer som leukemi og brystkreft .
Flere karakteriserende faktorer fører til at den foreslåtte ideen om neuronale stamceller (NSC) er opprinnelsen til BTSC, ettersom de deler flere funksjoner. Disse funksjonene er vist i figuren.
Denne gruppen gir bevis på SVZs tilsynelatende rolle i tumorigenese som demonstrert av besittelse av mitogene reseptorer og deres respons på mitogen stimulering, spesielt type C -celler som uttrykker den epidermale vekstfaktorreseptoren (EGFR), noe som gjør dem svært proliferative og invasive. I tillegg ble det funnet at eksistensen av mikroglia og endotelceller i SVZ forbedrer nevrogenesen , i tillegg til at den gir en retningsbestemt migrasjon av nevroblaster fra SVZ.
Nylig har menneskelig SVZ blitt karakterisert hos hjernesvulstpasienter på fenotypisk og genetisk nivå. Disse dataene viser at for halvparten av pasientene er SVZ et nøyaktig sted for tumorigenese, mens det for de resterende pasientene representerer en infiltrert region. Dermed er det tydelig mulig at det hos mennesker eksisterer et forhold mellom NSC-generasjonen i regionen og de konsekvent selvfornyende cellene i primære svulster som viker for sekundære svulster når de først er fjernet eller bestrålet.
Selv om det gjenstår å bevise om SVZ-stamceller er opprinnelsescelle for hjernesvulster som gliomer, er det sterke bevis som tyder på økt tumoraggressivitet og dødelighet hos pasienter hvis gliomer av høy kvalitet infiltrerer eller kontakter SVZ.
Ved prostatakreft er tumorindusert nevrogenese preget av rekruttering av nevrale stamceller (NPC) fra SVZ. NPC -er infiltrerer svulsten der de differensierer til autonome nevroner (hovedsakelig adrenerge nevroner) som stimulerer tumorvekst.