Familiær adenomatøs polypose - Familial adenomatous polyposis
| Familiær adenomatøs polypose | |
|---|---|
| Andre navn | FAP |
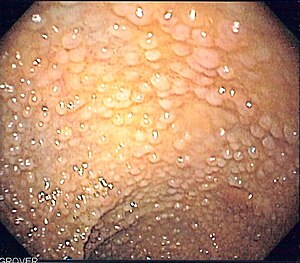 | |
| Endoskopisk bilde av sigmoid kolon av pasient med familiær adenomatøs polypose | |
| Spesialitet | Gastroenterologi , onkologi |
| Komplikasjoner | Tykktarmskreft |
| Vanlig start | <35 år |
| Varighet | Livslang |
| Typer | Klassisk eller svekket |
| Årsaker | APC -genmutasjon |
| Diagnostisk metode |
Koloskopi Genetisk testing |
| Differensialdiagnose | Lynch syndrom , MUTYH-assosiert polypose |
| Behandling | Koloskopi Polypektomi Øvre endoskopi Kolektomi |
| Frekvens | 1 av 10.000 - 15.000 |
Familial adenomatøs polypose ( FAP ) er en autosomal dominerende arvelig tilstand der mange adenomatøse polypper hovedsakelig dannes i epitelet i tykktarmen . Mens disse polyppene starter godartet , skjer ondartet transformasjon til tykktarmskreft når de ikke blir behandlet. Tre varianter er kjent for å eksistere, FAP og svekket FAP (opprinnelig kalt arvelig flat adenomsyndrom ) er forårsaket av APC- gendefekter på kromosom 5 mens autosomal recessiv FAP (eller MUTYH-assosiert polypose ) er forårsaket av defekter i MUTYH- genet på kromosom 1 Av de tre er FAP i seg selv den mest alvorlige og vanligste; selv om for alle tre er de resulterende kolonpolypper og kreftformer i utgangspunktet begrenset til tarmveggen. Påvisning og fjerning før metastase utenfor tykktarmen kan redusere og i mange tilfeller eliminere spredning av kreft.
Hovedårsaken til FAP er en genetisk mutasjon - en endring i kroppens svulstundertrykkende gener som forhindrer utvikling av svulster. Endringen gjør at mange celler i tarmveggen kan utvikle seg til potensielt kreftige polypper når de vanligvis når slutten av livet; uunngåelig vil en eller flere til slutt utvikle seg og gi kreft (7% risiko ved 21 år, øker til 87% ved 45 år og 93% etter 50 år). Disse genendringene utløser ikke kreft, men snarere reduserer de kroppens evne til å forhindre at celler blir kreftfremkallende. Selv med genendringen kan det fortsatt ta tid før en celle faktisk utvikler seg som er kreftsyk som følge av det, og genet kan i noen tilfeller fortsatt delvis fungere for å kontrollere svulster, derfor tar kreft fra FAP mange år å utvikle og er nesten alltid en sykdom hos voksne.
Den andre formen for FAP, kjent som svekket familiær adenomatøs polypose, har APC -genet funksjonelt, men lett svekket. Den er derfor litt i stand til å fungere som vanlig. Dempet FAP gir fortsatt en høy 70% livstidsrisiko for kreft (som estimert), men presenterer vanligvis med langt færre polypper (vanligvis 30) i stedet for hundrevis eller tusenvis som vanligvis finnes i FAP, og oppstår i en alder da FAP vanligvis ikke lenger er anses sannsynlig - vanligvis mellom 40 og 70 år (gjennomsnittlig 55) i stedet for de mer vanlige 30 -årene oppover. Fordi den har langt færre polypper, kan alternativene for behandling være forskjellige.
Den tredje varianten, autosomal recessiv familiær adenomatøs polypose eller MUTYH-assosiert polypose , er også mildere og krever, som navnet antyder, at begge foreldrene er 'bærere' for å manifestere tilstanden.
I noen tilfeller kan FAP manifestere seg høyere i tykktarmen enn vanlig (for eksempel den stigende tykktarmen , eller proksimalt til miltbøyningen , eller i magen eller tolvfingertarmen) der de ikke viser symptomer før kreft er tilstede og er langt fremme. APC -mutasjoner har vært knyttet til visse andre kreftformer som kreft i skjoldbruskkjertelen . Siden mutasjonen som forårsaker FAP er autosomaldominant, kan den arves direkte fra en av foreldrene til et barn. Det eksisterer en genetisk blodprøve av APC -genet som kan avgjøre om det er tilstede, og derfor kan forutsi muligheten for FAP. Personer i fare (på grunn av familiebånd eller genetisk testing) tilbys vanligvis rutinemessig overvåking av tarmkanalen hvert 1-3 år for livet, fra puberteten for FAP og tidlig voksen alder for svekkede former. Tykktarmsreseksjon kirurgi anbefales hvis det finnes mange polypper på grunn av høy risiko for tidlig død av tykktarmskreft. Det finnes internasjonale polyposisregistre som sporer kjente tilfeller av FAP- eller APC -gendefekter, for forskning og kliniske formål. Mutasjon av APC forekommer også ofte i tilfeller av kolorektalt karsinom, og understreker viktigheten av denne kreftformen.
Tegn og symptomer
Fra ungdomsårene utvikler pasienter med denne tilstanden gradvis (og mye av tiden asymptomatisk) hundrevis til tusenvis av kolorektale polypper (og noen ganger polypper andre steder ) - små abnormiteter på overflaten av tarmkanalen , spesielt i tykktarmen, inkludert tykktarmen eller endetarm . Disse kan blø og føre til blod i avføringen. Hvis blodet ikke er synlig, er det fortsatt mulig for pasienten å utvikle anemi på grunn av gradvis utvikling av jernmangel. Hvis malignitet utvikler seg, kan dette føre til vekttap , endret tarmvaner eller til og med metastase i leveren eller andre steder. FAP kan også utvikle seg "stille" hos noen individer, og gir få eller ingen tegn før det har utviklet seg til avansert tykktarmskreft .
Fordi familiær polypose utvikler seg veldig gradvis over år, og kan manifestere seg i en "svekket" form enda mer gradvis, kan polypper som følge av FAP føre til at kreft utvikler seg når som helst fra ungdom til alderdom.
Avhengig av arten av defekten i APC -genet, og om det er den fulle eller dempede formen, kan familiær polypose manifestere seg som polypper i tykktarmen eller i tolvfingertarmen , eller i en hvilken som helst kombinasjon av disse. Derfor er fravær av polypper i for eksempel endetarmen ikke i seg selv tilstrekkelig til å bekrefte fravær av polypper. Det kan være nødvendig å vurdere og visuelt undersøke andre mulige deler av tarmkanalen. Koloskopi foretrekkes fremfor sigmoidoskopi for dette, da det gir bedre observasjon av den vanlige høyre side av polypper.
Den genetiske determinanten ved familiær polypose kan også disponere bærere for andre maligniteter, for eksempel i tolvfingertarmen og magen (spesielt ampullært adenokarsinom). Andre tegn som kan peke til FAP er pigmenterte lesjoner i netthinnen ( "CHRPE-medfødt hypertrofi av det retinale pigmentepitel"), kjeve cyster, talg cyster , og osteomata (godartede bentumorer). Kombinasjonen av polypose, osteomer, fibromas og talg cyster er betegnet Gardner syndrom (med eller uten unormal arrdannelse).
Genetikk
Familiær adenomatøs polypose kan ha forskjellige arvsmønstre og forskjellige genetiske årsaker. Når denne tilstanden skyldes mutasjoner i APC -genet , arves den i et autosomalt dominant mønster, noe som betyr at en kopi av det endrede genet er tilstrekkelig til å forårsake lidelsen. Forekomsten av malignitet i disse tilfellene nærmer seg 100%. I de fleste tilfeller har en berørt person en forelder med tilstanden.
APC -genmutasjonsvarianter
Den APC er et svulsthemmer-gen som er ansvarlig for produksjonen av adenomatøs polypose coli (APC), en stor flerfunksjonstumorundertrykkende protein som virker som en "gatekeeper" for å forebygge utvikling av svulster. (APC regulerer β-catenin , et protein som spiller en avgjørende rolle i cellekommunikasjon, signalering, vekst og kontrollert ødeleggelse, men som etterlater seg ukontrollert, gir også opphav til mange kreftformer ). En feil i APC -genet betyr at APC ikke er så effektivt som det burde være, og over tid er det sannsynlig at noen celler som burde vært kontrollert av APC ikke vil være det, og i stedet vil fortsette å utvikle seg og bli kreftfremkallende. Ved kjent polypose manifesterer de seg vanligvis som polypper - små abnormiteter på overflaten av tarmkanalen .
Selv om polyppene iboende er godartede, har det første trinnet i to-hit-hypotesen allerede funnet sted: den arvelige APC-mutasjonen. Ofte er den gjenværende "normale" allelen mutert eller slettet, noe som akselererer generering av polypper. Ytterligere mutasjoner (f.eks. I p53 eller kRAS ) til APC-muterte celler er mye mer sannsynlig å føre til kreft enn de ville gjort i ikke-muterte epitelceller .
Den normale funksjonen til APC -genproduktet blir fortsatt undersøkt; den er tilstede i både cellekjernen og membranen. Den kanoniske svulstundertrykkende funksjonen til APC er undertrykkelse av β-katenin, men andre svulstundertrykkende funksjoner til APC kan være relatert til celleadherens og cytoskjelettorganisasjon .
Mutasjon av APC forekommer også ofte i tilfeller av kolorektalt karsinom, og understreker viktigheten av denne kreftformen.
MUTYH genmutasjonsvarianter
MUTYH koderDNA-reparasjonsenzym MYH glycosylase . Under normale mobilaktiviteter blir guanin noen ganger endret av oksygen , noe som får det til å koble seg sammen med adenin i stedet for cytosin . MYH -glykosylase fikser disse feilene ved reparasjon av base -eksisjon, slik at mutasjoner ikke akkumuleres i DNA og fører til tumordannelse. Når MYH -glykosylase ikke fungerer som det skal, kan det oppstå DNA -feil for å starte tumorigenese med en klinisk presentasjon som ligner den hos pasienter med APC -mutasjoner.
Mutasjoner i MUTYH -genet arves i et autosomalt recessivt mønster, noe som betyr at to kopier av genet må endres for at en person skal bli påvirket av lidelsen. Oftest påvirkes ikke foreldrene til et barn med en autosomal recessiv lidelse, men er bærere av en kopi av det endrede genet.
Dyremodeller
" Apc Min " -musemodellen ble beskrevet i 1990 og bærer en Apc -allel med stoppkodon i posisjon 850. Heterozygositet for denne mutasjonen resulterer i en fullt penetrerende fenotype på de fleste genetiske bakgrunner, med mus på sensitiv bakgrunn som utvikler over 100 svulster i tarmkanalen. Antall og plassering av tarmsvulstene er endret av ulinkede gener. Mange andre modeller har siden dukket opp, inkludert en modell for svekket FAP (1638N-modellen) og flere betingede mutanter som tillater vevsspesifikk eller tidsmessig ablasjon av genfunksjon. For mer informasjon, se musemodeller for tykktarms- og tarmkreft .
I 2007 ble "ApcPirc" -rottemodellen isolert med et stoppkodon i posisjon 1137. I motsetning til musemodellene der> 90% av svulstene dannes i tynntarmen, danner Pirc -rotten fortrinnsvis (> 60%) svulster i tykktarmen, lik den menneskelige kliniske presentasjonen.
Diagnose

Å stille diagnosen FAP før utviklingen av tykktarmskreft er viktig ikke bare for den enkelte, men også av hensyn til andre familiemedlemmer som kan bli påvirket. Det finnes to diagnostiske metoder:
- Koloskopi er den vanlige valgfrie diagnostiske testen, da den favoriserer den vanlige høyre side av polypper bedre enn sigmoidoskopi hvis mutasjonen er svekket FAP, og kan bekrefte eller tillate (a) den faktiske kliniske presentasjonen og enhver endring i tilstanden til 'i fare' individ, (b) kvantifisering av polypper gjennom tykktarmen, (c) en histologisk diagnose (deteksjon av celle-/krefttype) og (d) der polypper finnes, kan det tyde på om poliklinisk eksisjon (fjerning) er levedyktig eller kirurgisk er anbefalt. Bariumklyster og virtuell koloskopi (en form for medisinsk avbildning) kan også brukes til å foreslå diagnosen FAP.
- Genetisk testing gir den ultimate diagnosen i 95% av tilfellene; genetisk rådgivning er vanligvis nødvendig i familier der FAP har blitt diagnostisert. Testing kan også hjelpe til med å diagnostisere grensetilfeller i familier som ellers er kjent for p34.3 og p32.1 (1p34.3 – p32.1). Testing kan bare vise om en person er utsatt for FAP eller utelukke det (dvs. om de arvet det defekte APC -genet eller ikke). Det kan ikke bestemme den faktiske tilstanden til en pasient; dette kan bare bli funnet ved direkte fysisk undersøkelse.
NCBI uttaler at leger må sikre at de forstår "risiko, fordeler og begrensninger" ved enhver genetisk test som ble gjort siden i 1997 "for nesten en tredjedel av individer som ble vurdert for FAP, tolket legen feil resultatene".
Når diagnosen FAP er gjort, er det nødvendig med tett koloskopisk overvåking med polypektomi .
Prenatal testing er mulig hvis en sykdomsfremkallende mutasjon er identifisert hos et berørt familiemedlem; Imidlertid er prenatal testing for vanligvis sykdommer hos voksne uvanlig og krever nøye genetisk rådgivning .
Ultralyd i magen og blodprøver som evaluerer leverfunksjon utføres ofte for å utelukke metastaser i leveren.
Ledelse

På grunn av måten familiær polypose utvikler seg på, er det mulig å ha den genetiske tilstanden, og derfor være i fare, men har ingen polypper eller problemer så langt. Derfor kan et individ bli diagnostisert "i fare for" FAP, og kreve rutinemessig overvåking, men ikke (ennå) faktisk har FAP (dvs. bærer et defekt gen, men foreløpig ser det ikke ut til å ha noen faktisk medisinsk problem som følge av dette ). Klinisk ledelse kan dekke flere områder:
- Identifisere personer som kan være i fare for FAP: vanligvis fra familiens medisinske historie eller genetisk testing
- Diagnose (bekrefter om de har FAP) - dette kan gjøres enten ved genetisk testing, som er endelig eller ved å visuelt kontrollere selve tarmkanalen.
- Det er viktig å merke seg at visuell undersøkelse, eller overvåking, ikke kan 'fjerne' en person for risiko. Den kan bare si hva tilstanden deres er på det tidspunktet. Hvis personen på et tidspunkt i livet utvikler mange polypper, vil dette ha en tendens til å foreslå en diagnose av FAP. (Fravær av polypper "klarer" ikke en person, ettersom polypper kan utvikle seg senere i livet; også noen polypper over tid er ikke så uvanlige hos mennesker uten FAP. Imidlertid vil et betydelig antall eller en mengde polypper generelt ha en tendens til å foreslå en diagnose av FAP og histopatologi for å avgjøre om noen polypper er kreftfrie.)
- Screenings-/overvåkingsprogrammer innebærer visuell undersøkelse av tarmkanalen for å kontrollere dens sunne tilstand. Det utføres som et rutinemessig spørsmål hvert par år hvor det er grunn til bekymring når enten (a) en genetisk test har bekreftet risikoen eller (b) en genetisk test ikke er utført av noen grunn, så den faktiske risikoen er ukjent. Screening og overvåking gjør at polypose kan oppdages visuelt før det kan bli livstruende.
- Behandling, vanligvis kirurgi av en eller annen art, er involvert hvis polypose har ført til et stort antall polypper, eller en betydelig risiko for kreft eller faktisk kreft.
Familie historie
NCBI uttaler at "Selv om de fleste individer som er diagnostisert med en APC-assosiert polyposetilstand, har en berørt forelder, kan familiehistorien se ut til å være negativ på grunn av manglende anerkjennelse av lidelsen hos familiemedlemmer, tidlig død av forelder før symptomdebut, eller sen utbrudd av sykdommen hos den berørte forelder. " I tillegg er rundt 20% av tilfellene en de novo mutasjon, og av de med en tilsynelatende de novo APC mutasjon (dvs. ingen kjent familiehistorie) har 20% somatisk mosaikk . Asymptomatiske individer (og derfor asymptomatiske familiemedlemmer) er også kjent for å eksistere.
Overvåkning
Overvåking innebærer levering av poliklinisk koloskopi , og noen ganger esophagogastroduodenoskopi i øvre mage -tarmkanalen (EGD, for å lete etter premaligant kreft i mage eller tolvfingertarmen ), vanligvis en gang hvert 1-3 år, og/eller en genetisk blodprøve for definitivt å bekrefte eller nekte følsomhet. Et lite antall polypper kan ofte bli fjernet (fjernet) under prosedyren hvis det blir funnet, men hvis det er mer alvorlige tegn eller tall, innleggelse kirurgi kan være nødvendig.
NCBI uttaler at når et individ er identifisert som FAP, eller mutasjonene som resulterer i FAP: "Det er hensiktsmessig å evaluere foreldrene til et berørt individ (a) med molekylær genetisk testing av APC hvis den sykdomsfremkallende mutasjonen er kjent i proband [person først identifisert med tilstanden] eller (b) for kliniske manifestasjoner av APC-assosierte polyposetilstander ".
Behandling
Behandling for FAP avhenger av genotypen . De fleste individer med APC-mutasjonen vil utvikle tykktarmskreft innen 40 år, selv om den mindre vanlige dempede versjonen vanligvis manifesterer seg senere i livet (40–70). Følgelig kan profylaktisk kirurgi i mange tilfeller anbefales før 25 år, eller ved påvisning hvis den blir aktivt overvåket. Det er flere kirurgiske alternativer som involverer fjerning av enten tykktarmen eller både tykktarmen og endetarmen.
- Rektum involvert: endetarmen og delen eller hele tykktarmen fjernes. Pasienten kan trenge en ileostomi (permanent stomi der avføring går ned i en pose på magen) eller få en ileo-anal pose rekonstruksjon. Beslutningen om å fjerne endetarmen avhenger av antall polypper i endetarmen, så vel som familiehistorien. Hvis endetarmen har få polypper, er tykktarmen delvis eller helt fjernet, og tynntarmen (ileum) kan i stedet kobles direkte til endetarmen ( ileorektal anastomose ).
- Endetarm ikke involvert: Den delen av tykktarmen som manifesterer polypper kan fjernes og endene "kobles til igjen" ( delvis kolektomi ), en operasjon som har en betydelig helbredelsestid, men som etterlater livskvaliteten stort sett intakt.
Profylaktisk kolektomi er indikert hvis mer enn hundre polypper er tilstede, hvis det er alvorlig dysplastiske polypper, eller hvis flere polypper større enn 1 cm er tilstede.
Behandling for de to mildere formene av FAP kan være vesentlig forskjellig fra den mer vanlige varianten, ettersom antallet polypper er langt færre, noe som gir flere alternativer.
Ulike medisiner blir undersøkt for å bremse ondartet degenerasjon av polypper, mest fremtredende de ikke-steroide antiinflammatoriske legemidlene (NSAIDs). NSAIDS har vist seg å redusere antallet polypper betydelig, men endrer vanligvis ikke behandlingen siden det fortsatt er for mange polypper som skal følges og behandles endoskopisk. Legemidlet eflornithine , en hemmer av ornitindecarboxylase som vanligvis brukes til å behandle trypanosomiasis , blir undersøkt som en potensiell forebyggende medisin i kombinasjon med NSAID celecoxib for behandling av FAP. Et annet undersøkelsesmiddel er sulindac , også brukt i kombinasjon med NSAIDs.
Prognose
Før du når de avanserte stadiene av tykktarmskreft, er polyppene begrenset til tarmens indre vegg og tykkelse og metastaserer ikke eller "sprer seg". Så forutsatt at FAP oppdages og kontrolleres enten på pre-kreftstadiet eller når noen kreftpolypper fortsatt er indre i tarmkanalen, har kirurgi en meget høy suksessrate for å forebygge eller fjerne kreft, uten gjentagelse, siden stedene som gir kreft blir fysisk fjernet i toto av operasjonen.
Etter en operasjon, hvis en delvis kolektomi er utført, er det nødvendig med koloskopisk overvåking av den gjenværende tykktarmen, ettersom personen fortsatt har risiko for å utvikle tykktarmskreft. Imidlertid, hvis dette skjedde, ville det være en ny hendelse fra polypper som utviklet seg på nytt i den ikke -fjernede delen av tykktarmen etter operasjonen, i stedet for en retur eller metastase av kreft som ble fjernet ved den opprinnelige operasjonen.
Epidemiologi
Forekomsten av mutasjonen er mellom 1 av 10 000 og 1 av 15 000 fødsler. Etter 35 år har 95% av individer med FAP (> 100 adenomer) polypper. Uten kolektomi er tykktarmskreft praktisk talt uunngåelig. Gjennomsnittsalderen for tykktarmskreft hos ubehandlede individer er 39 år (område 34–43 år).
Dempet FAP oppstår når APC er defekt, men fortsatt noe funksjonell. Som et resultat beholder den en del av sin evne til å undertrykke polypper. Derfor manifesteres svekket FAP som kolorektal kreft uvanlig sent (alder 40–70, gjennomsnitt = 55), og vanligvis med få, eller i det minste langt færre polypper (vanligvis 30), enn den mer vanlige versjonen av FAP, i en alder da FAP regnes ikke lenger som en stor sannsynlighet eller risiko i henhold til vanlig FAP -epidemiologi.
Sammenligning av FAP -varianter
Denne tabellen sammenligner de forskjellige undertyper av FAP:
| Punkt | FAP | Dempet FAP | MUTYH Associated FAP |
| Gene | APC | APC | MUTYH |
| Typisk polyppmanifestasjon | Hundrevis / tusenvis | Under 100 (0–470, typ. 30), noen ganger flat i stedet for polypoid morfologi, og mer proksimalt for miltbøyningen. I en studie av 120 individer hadde 37% (N = 44) <10 polypper; 3 av disse 44 hadde tykktarmskreft]. Gastriske fundiske polypper og duodenale adenomer er også sett. Derfor kan polypper og kreft manifestere seg i den øvre delen av tykktarmen eller øvre mage -tarmkanal i stedet for de vanlige stedene | ? |
| Typiske kjernediagnostiske kriterier | (a) 100+ polypper og alder under 40 år, ELLER (b) polypper og FAP i en slektning | Ikke avgjort ennå. (a) ingen familiehistorie med 100+ polypper før 30 år PLUS EN AV 10–99 polypper / 100+ polypper og over 35 til 40 år / kolorektal kreft før 60 år og slektninger med flere adenomatøse polypper, ELLER (b) Familiehistorie av 10 til 99 adenomer diagnostisert etter 30 år | ? |
| Alder der polypper manifesterer seg | 7–36 (type 16), raskt økende deretter | ? | ? |
| Kolorektal kreftrisiko ( penetrasjon ) og alder hvis den ikke behandles | "uunngåelig .. praktisk talt 100%": 7% etter 21 år, 87% etter 45 år, 93% etter 50 år. Typiske aldre: 34–43 (gjennomsnitt 39) | "Lavere .. mindre kjent .. estimert 70% etter 80 år". Sovaria uttaler fra 1998 at "gjennomsnittsalderen ved CRC -diagnose er ∼58 år" | ? |
| Variasjon | Inter- og intrafamilial fenotypisk variasjon er vanlig | Se FAP | ? |
| Mulige ikke-kolon manifestasjoner | "polypper i magesekken og tolvfingertarmen, osteomer, tannfeil, medfødt hypertrofi av retinalpigmentepitelet (CHRPE), bløtvevssvulster, desmoid svulster og tilhørende kreftformer" | Når det gjelder FAP, men "CHRPE og desmoid svulster er sjeldne", og også kreft i skjoldbruskkjertelen legges til. | ? |
| Andre livstidsrisiko | "Tynntarm [tolvfingertarmen eller periampulla] karsinom 4–12%[distalt til tolvfingertarmen] Sjelden; Bukspyttkjertel Adenokarsinom ~ 1%; Papillært skjoldbruskskreft 1-2%; CNS [typ. Medulloblastoma] <1%; Leverhepatoblastom 1,6%; Galle kanaler adenokarsinom Lav men økt; Mage adenokarsinom <1% i vestlige kulturer. " | ? | ? |
| Arv | "arvet på en autosomal dominerende måte. Omtrent 75% -80% av individer med APC-assosiert polyposetilstand har en berørt forelder. Avkom til et berørt individ har 50% risiko for å arve den sykdomsfremkallende mutasjonen" | Samme som FAP | Forskjellig - recessiv (krever at 2 foreldre er bærere) |
| Genetisk oversikt og genetisk deteksjon | "Full gensekvensering av alle APC-eksoner og intron-ekson-grenser ser ut til å være den mest nøyaktige kliniske testen som er tilgjengelig. De fleste APC-mutasjoner er tull eller rammeskiftmutasjoner som forårsaker for tidlig avkortning av APC-proteinet. Sannsynligheten for å oppdage en APC-mutasjon er høy avhengig av alvorlighetsgraden av tykktarmspolyposen og på familiehistorien .. ◦ Omtrent 20% av individer med en tilsynelatende de novo APC-mutasjon .. Markørene som brukes for koblingsanalyse av APC-assosierte polyposetilstander er svært informative og svært tett knyttet til APC locus; dermed kan de brukes med mer enn 98% nøyaktighet i mer enn 95% av familier med en APC-assosiert polyposetilstand. Koblingstesting er ikke mulig for familier med en enkelt berørt person, en situasjon som ofte oppstår når en individ har en de novo genmutasjon og ingen påvirket avkom .. Hvis det ikke blir funnet noen APC -mutasjon som forårsaker sykdom, molekylær genetisk testing av MUTYH (se differensialdiagnose) sh skal vurderes. " | "Færre enn 30% av individer med svekkede fenotyper forventes å ha en identifiserbar APC -mutasjon" (se også detaljer under FAP) | ? |
| Genotype-fenotype [kjernetilstand] | Hyppigste APC -mutasjon er ved kodon 1309 og fører til et stort antall polypper i en tidlig alder (~ 20). Rikelig polypose (gjennomsnitt = 5000) rapportert med mutasjoner i kodonene 1250–1464. De fleste delvise og hele APC -slettingene er assosiert med 100–2000 kolonadenomer, selv om svekket FAP er sett. Eksempel på typiske begynnelsesaldre: mellom kodon 168 og 1580 (unntatt 1309) = 30 år, 5 'med kodon 168 og 3' med kodon 1580 = 52 år. | Dempet FAP er assosiert med mutasjoner (typisk avkorting) i 5' -delen av genet (kodonene 1–177), ekson 9, og den distale 3 'enden av genet; interstitielle slettinger av kromosom 5q22 som inkluderer APC; del- og helgen-sletting; og somatisk mosaikk for APC -mutasjoner som generelt er assosiert med klassisk FAP. Sovaria -stater svekket FAP er "forårsaket av mutasjoner i tre forskjellige områder av APC -genet - 5' -enden i regionen som strekker seg over ekson 4 og 5, ekson 9 og den ekstreme 3' -enden. Fenotypisk uttrykk i disse tre grupper av slekt er variabel, men er definitivt mildere enn i klassisk FAP "og at endetarmspolypper er sjeldne i svekket FAP, men ennå ikke bekreftet om dette også betyr at rektal kreftrisiko også er lavere. | ? |
| Genotype-Fenotype [Andre ekstrakoloniske forhold] | Fremtredende ekstrakoloniske manifestasjoner korrelerer ofte (men ikke helt) med mer distale APC -mutasjoner. Generell studie av FAP pluss ekstrakoloniske symptomer viste : mutasjoner i kodon 1395–1493 har betydelig høyere frekvens av desmoid svulster, osteomer og epidermoid cyster enn de med mutasjoner i kodon 177–452; mutasjoner i kodoner 1395–1493 har betydelig høyere frekvens av desmoid svulster og osteomer enn de med mutasjoner i kodon 457–1309; ingen individer med mutasjoner i kodonene 177–452 utviklet osteomer eller periampullær kreft; bare individer med mutasjoner i kodoner 457–1309 utviklet hepatoblastom og/eller hjernesvulster. Duodenale adenomer : Fire ganger økt risiko med mutasjoner mellom kodonene 976 og 1067. Desmoid tumorer : mutasjoner 3 'til kodon 1399 var assosiert med desmoid tumorutvikling med et oddsforhold på 4,37; desmoid svulster hos 20% av individer med mutasjoner 5 'til kodon 1444, 49% av individer med mutasjoner 3' til kodon 1444 og 61% av individer med mutasjoner i kodon 1445–1580; flere familier med alvorlige desmoid svulster hadde mutasjoner i ytterste 3' -enden; konsekvent assosiasjon av desmoid svulster med mutasjoner distale til kodon 1444. CHRPE er assosiert med: mutasjoner mellom kodonene 311 og 1444; sletting av hele APC -genet. Skjoldbruskkjertelkreft og FAP : Hos 24 individer var flertallet av identifiserte mutasjoner 5 'til kodon 1220 [Cetta et al. 2000]; 9 av 12 individer hadde APC -mutasjoner identifisert proksimalt for mutasjonsklyngeområdet (kodonene 1286–1513). Generell gjennomgang av litteraturen (til august 2006) : avslørte 89 submikroskopiske APC-slettinger (42 del- og 47 helgen-slettinger). Ekstrakoloniske funn ble sett i 36% av tilfellene, uten signifikante forskjeller i dem med delvis vs helgen-sletting. | ? | ? |
| Utbredelse | "2,29 til 3,2 per 100 000 individer. APC-assosierte polyposetilstander utgjorde historisk omtrent 0,5% av alle tykktarmskreft; dette tallet synker etter hvert som flere familiemedlemmer i risiko gjennomgår vellykket behandling etter tidlig polypdeteksjon og profylaktisk kolektomi." | "Sannsynligvis underdiagnostisert, gitt det lavere antallet tykktarmspolypper og lavere risiko for tykktarmskreft sammenlignet med klassisk FAP" | ? |
| Behandling av manifestasjoner | Klassisk FAP: "Kolektomi anbefales etter at adenomer dukker opp; kolektomi kan forsinkes avhengig av størrelse og antall adenomatøse polypper. Kolektomi anbefales vanligvis når mer enn 20 eller 30 adenomer eller flere adenomer med avansert histologi har utviklet seg" | "Kolektomi kan være nødvendig, men hos omtrent en tredjedel av individene er kolonpolyppene begrenset nok til at overvåking med periodisk koloskopisk polypektomi er tilstrekkelig" | ? |
| Overvåking (overvåking) når risikoen er etablert | "Sigmoidoskopi eller koloskopi hvert 1-2 år, fra ti til 12 år; koloskopi, når polypper er påvist; årlig koloskopi, hvis kolektomi blir forsinket mer enn et år etter at polypper dukker opp (alder 10 til 20 år med visse mildere symptomer, forsinkelse i kolektomi kan vurderes); Esophagogastroduodenoscopy (EGD) etter 25 år eller før kolektomi og gjentatt hvert 1-3 år; i noen tilfeller endoskopisk retrograd kolangiopankreatografi (ERCP) for å vurdere for adenomer i den vanlige gallegangen; liten- tarmavbildning når duodenale adenomer oppdages eller før kolektomi, gjentatt hvert 1-3 år avhengig av funn; screening for hepatoblastom (optimalt intervall ukjent, et papir anbefaler "minst hver tredje måned"); årlig fysisk undersøkelse, inkludert evaluering for ekstraintestinal manifestasjoner og palpasjon av skjoldbruskkjertelen med tanke på oppfølgende ultralydundersøkelse og finnålssuging hvis skjoldbruskknuter er tilstede " | "Koloskopi hvert annet til tredje år, fra 18 til 20 år; esophagogastroduodenoscopy (EGD) som begynner 25 år eller før kolektomi og gjentas hvert 1-3 år. I noen tilfeller kan endoskopisk retrograd kolangiopankreatografi (ERCP) være nødvendig å evaluere for adenomer i den vanlige gallegangen; årlig fysisk undersøkelse med palpasjon av skjoldbruskkjertelen med tanke på oppfølgende ultralydundersøkelse og finnålssuging hvis skjoldbruskknuter er tilstede. Kolektomi anbefales vanligvis når mer enn 20 eller 30 adenomer eller flere adenomer med avansert histologi har utviklet seg. " Sovaria uttaler fra 1998 at "koloskopi, i motsetning til sigmoidoskopi, bør anbefales for endoskopisk overvåking på grunn av plasseringen av kolorektale adenomer på høyre side; UGI endoskopisk overvåking er berettiget i et forsøk på å oppdage premaligne mage- eller duodenale svulster; individer som er berørt med [dempet FAP] kan kreve total kolektomi med ileo-rektal anastomose bare når profylaktisk kolektomi anbefales | ? |
| Beslutning om å overvåke | "Tidlig gjenkjenning kan tillate rettidig intervensjon og forbedret sluttresultat; derfor er overvåking av asymptomatiske, utsatte barn for tidlige manifestasjoner passende; genetisk testing er mer kostnadseffektivt enn sigmoidoskopi for å bestemme hvem i familien som er berørt; individer diagnostisert med APC -assosierte polyposetilstander som følge av at en berørt slektning har en betydelig større forventet levealder enn de individer som er diagnostisert på grunnlag av symptomer. Ettersom tykktarmsovervåking for de som er utsatt for klassisk FAP begynner allerede i alderen ti til 12 år, molekylær genetisk testing tilbys vanligvis barn med risiko for klassisk FAP etter ti år. Genetisk testing ved fødsel kan også være berettiget, ettersom noen foreldre og barneleger kan vurdere hepatoblastom screening fra spedbarn til fem år i berørte avkom. Ingen bevis peker på en optimal alder for screening. " | Se FAP. Også "Tykktarmsscreening for de med svekket FAP begynner i alderen 18 til 20 år; derfor bør molekylær genetisk testing tilbys de som er utsatt for svekket FAP ved omtrent 18 år." | ? |
| Arv og implikasjoner av bekreftet diagnose for andre nære slektninger | APC-assosierte polyposetilstander arves på en autosomal dominerende måte. Omtrent 20–25% har det endrede genet som et resultat av en de novo genmutasjon. Lite eller ingen bevis på moder/farlig skjevhet, eller effekt relatert til avansert farsalder, i de novo mutasjoner. Søsken har klassisk 50% risiko for å dele tilstanden hvis den er arvet og ikke de novo og en "lav", men litt høyere risiko enn generelt hvis de novo , derfor bør genetisk testing tilbys. Avkom har hver 50% sjanse for arv. Andre familiemedlemmer er i fare hvis foreldrene deler den samme mutasjonen. Germline -mosaikk har blitt dokumentert i asymptomatiske tilfeller. Prenatal testing er mulig via fosterekstraktert DNA . | Se FAP | ? |
Polyposis -registre
På grunn av FAPs genetiske natur, har polyposeregistre blitt utviklet rundt om i verden. Formålet med disse registrene er å øke kunnskapen om overføring av FAP, men også å dokumentere, spore og varsle familiemedlemmer til berørte personer. En studie har vist at bruk av et register for å varsle familiemedlemmer (henvendelser) reduserte dødeligheten betydelig sammenlignet med probander . Den Markus polypose registret er den eldste i verden, startet i 1924, og mange andre polypose registre nå eksisterer.
Se også
Referanser
Videre lesning
- Jasperson, Kory W .; Patel, Swati G .; Ahnen, Dennis J. (2. februar 2017). "APC-assosierte polyposebetingelser" . I Adam MP; Ardinger HH; Pagon RA; Wallace SE (red.). GeneReviews . Seattle WA: University of Washington. PMID 20301519 . NBK1345. - fullstendig klinisk oppsummering av FAP og svekket FAP, inkludert livstidsrisiko, epidemiologi etc.
- Familial adenomatøs polypose ved NLM Genetics Home Reference
- Familial adenomatøs polypose - eMedicine Gastroenterology
- Tykktarm, polyposis syndromer
- Informasjonssammendrag fra National Cancer Institute: Genetics of Colorectal Cancer
Eksterne linker
| Klassifisering | |
|---|---|
| Eksterne ressurser |

