Pseudomonas aeruginosa -Pseudomonas aeruginosa
| Pseudomonas aeruginosa | |
|---|---|

|
|
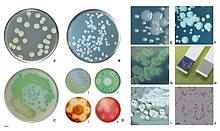
| P. aeruginosa kolonier på blodagar | |
|
Vitenskapelig klassifisering |
|
| Domene: | Bakterie |
| Filum: | Proteobakterier |
| Klasse: | Gammaproteobakterier |
| Rekkefølge: | Pseudomonadales |
| Familie: | Pseudomonadaceae |
| Slekt: | Pseudomonas |
| Artgruppe : | Pseudomonas aeruginosa gruppe |
| Arter: |
P. aeruginosa
|
| Binomisk navn | |
|
Pseudomonas aeruginosa (Schröter 1872)
Migula 1900 |
|
| Synonymer | |
|
|
Pseudomonas aeruginosa er en vanlig innkapslet , gramnegativ , streng aerob (selv om den kan vokse anaerob i nærvær av nitrat), stavformet bakterie som kan forårsake sykdom hos planter og dyr, inkludert mennesker. En art av betydelig medisinsk betydning, P. aeruginosa er et multimedikamentresistent patogen anerkjent for sin ubiquity, dets egen avanserte antibiotiske resistensmekanismer,og dens tilknytning til alvorlige sykdommer - sykehusinfeksjoner såsom ventilator assosiert pneumoni og forskjellige sepsis -syndromer .
Organismen regnes som opportunistisk i den grad alvorlig infeksjon ofte oppstår under eksisterende sykdommer eller tilstander - særlig cystisk fibrose og traumatiske forbrenninger. Det påvirker vanligvis de immunkompromitterte, men kan også infisere immunkompetenten som i folliculitt i boblebad . Behandling av P. aeruginosa -infeksjoner kan være vanskelig på grunn av dets naturlige resistens mot antibiotika. Når det er behov for mer avanserte antibiotika, kan bivirkninger oppstå.
Det er sitrat- , katalase- og oksidase -positivt . Den finnes i jord, vann, hudflora og de fleste menneskeskapte miljøer over hele verden. Den trives ikke bare i normale atmosfærer, men også i atmosfærer med lite oksygen , og har dermed kolonisert mange naturlige og kunstige miljøer. Den bruker et bredt spekter av organisk materiale til mat; hos dyr gjør dens allsidighet det mulig for organismen å infisere skadet vev eller de med redusert immunitet. Symptomene på slike infeksjoner er generalisert betennelse og sepsis . Hvis slike koloniseringer forekommer i kritiske kroppsorganer, for eksempel lungene , urinveiene og nyrene , kan resultatene være dødelige. Fordi den trives på fuktige overflater, finnes denne bakterien også på og i medisinsk utstyr , inkludert katetre , og forårsaker kryssinfeksjoner på sykehus og klinikker . Det er også i stand til å bryte ned hydrokarboner og har blitt brukt til å bryte ned tarballer og olje fra oljesøl . P. aeruginosa er ikke ekstremt virulent i sammenligning med andre store patogene bakteriearter - for eksempel Staphylococcus aureus og Streptococcus pyogenes - selv om P. aeruginosa er i stand til omfattende kolonisering og kan samle seg til varige biofilmer .
Nomenklatur
Ordet Pseudomonas betyr "falsk enhet", fra de greske pseudene ( gresk : ψευδής, falsk) og ( latin : monas , fra gresk : μονάς, en enkelt enhet). Stammeordet mon ble brukt tidlig i mikrobiologiens historie for å referere til bakterier , f.eks. Kongeriket Monera .
Artsnavnet aeruginosa er et latinsk ord som betyr irr ( "kobber rust"), med henvisning til den blå-grønne fargen på laboratoriet kulturer av arten. Dette blågrønne pigmentet er en kombinasjon av to metabolitter av P. aeruginosa , pyocyanin (blå) og pyoverdin (grønn), som gir den blågrønne karakteristiske fargen på kulturer. En annen påstand fra 1956 er at aeruginosa kan stamme fra det greske prefikset ae- som betyr "gammel eller gammel", og suffikset ruginosa betyr rynket eller humpete.
Navnene pyocyanin og pyoverdine er fra gresk, med pyo- , som betyr "pus", cyanin , som betyr "blått" og verdin , som betyr "grønt". Derfor refererer begrepet "pyocyaniske bakterier" spesielt til den "blå pus" som er karakteristisk for en P. aeruginosa -infeksjon. Pyoverdin i fravær av pyocyanin er en fluorescerende gul farge.
Biologi
Genom
Den genomet av P. aeruginosa består av en forholdsvis stor sirkulær kromosom (5,5 til 6,8 Mb) som bærer mellom 5.500 og 6.000 åpne leserammer , og av og til plasmider med forskjellige størrelser avhengig av belastningen. Sammenligning av 389 genomer fra forskjellige P. aeruginosa -stammer viste at bare 17,5% deles. Denne delen av genomet er kjernegenomet av P. aeruginosa .
| press: | VRFPA04 | C3719 | PAO1 | PA14 | PACS2 |
|---|---|---|---|---|---|
| Kromosomstørrelse (bp) | 6 818 030 | 6 222 097 | 6 264 404 | 6.537.648 | 6 492 423 |
| ORFer | 5 939 | 5.578 | 5.571 | 5 905 | 5 676 |
En komparativ genomisk studie (i 2020) analyserte 494 komplette genomer fra Pseudomonas -slekten, hvorav 189 var P. aeruginosa -stammer. Studien observerte at proteintallet og GC -innholdet varierte mellom henholdsvis 5500–7352 (gjennomsnitt: 6192) og mellom 65,6–66,9% (gjennomsnitt: 66,1%). Denne komparative analysen identifiserte ytterligere 1811 aeruginosa-kjerneproteiner, som står for mer enn 30% av proteomet. Den høyere prosentandelen aeruginosa-kjerneproteiner i denne sistnevnte analysen kan delvis tilskrives bruken av komplette genomer. Selv om P. aeruginosa er en meget veldefinert monofyletisk art, fylogenomisk og når det gjelder ANIm-verdier, er det overraskende mangfoldig når det gjelder proteininnhold, og avslører dermed et veldig dynamisk tilbehørsproteom, i henhold til flere analyser. Det ser ut til at industrielle stammer i gjennomsnitt har de største genomene, etterfulgt av miljøstammer, og deretter kliniske isolater. Den samme komparative studien (494 Pseudomonas -stammer, hvorav 189 er P. aeruginosa ) identifiserte at 41 av 1811 P. aeruginosa -kjerneproteinene bare var til stede i denne arten og ikke i noe annet medlem av slekten, med 26 (av de 41 ) blir kommentert som hypotetisk. Videre er ytterligere 19 ortologe proteingrupper tilstede i minst 188/189 P. aeruginosa -stammer og fraværende i alle de andre stammene i slekten.
Befolkningsstruktur
Befolkningen av P. aeruginosa danner tre hovedlinjer, preget av de ferdige genomene PAO1, PA14 og den svært divergerende PA7.
Mens P. aeruginosa generelt blir sett på som et opportunistisk patogen, ser det ut til at flere utbredte kloner har blitt mer spesialiserte patogener, spesielt hos pasienter med cystisk fibrose, inkludert Liverpool -epidemistammen (LES) som hovedsakelig finnes i Storbritannia, DK2 i Danmark, og AUST-02 i Australia (også tidligere kjent som AES-2 og P2). Det er også en klon som ofte blir infisert av hestens reproduktive områder.
Metabolisme
P. aeruginosa er en fakultativ anaerobe , ettersom den er godt tilpasset til å spre seg under forhold med delvis eller total oksygenmangel. Denne organismen kan oppnå anaerob vekst med nitrat eller nitritt som en terminal elektronakseptor . Når oksygen, nitrat og nitritt er fraværende, er det i stand til å gjære arginin og pyruvat ved fosforylering på substratnivå . Tilpasning til mikroaerobe eller anaerobe miljøer er avgjørende for visse livsstiler for P. aeruginosa , for eksempel under lungeinfeksjon ved cystisk fibrose og primær ciliary dyskinesi , hvor tykke lag av lungeslim og bakterielt produsert alginat som omgir slimhinne bakterielle celler kan begrense spredning av oksygen. P. aeruginosa vekst i menneskekroppen kan være asymptomatisk inntil bakteriene danner en biofilm, som overvelder immunsystemet. Disse biofilmene finnes i lungene til mennesker med cystisk fibrose og primær ciliary dyskinesi, og kan vise seg å være dødelige.
Mobilsamarbeid
P. aeruginosa er avhengig av jern som næringskilde for å vokse. Imidlertid er jern ikke lett tilgjengelig fordi det ikke er vanlig i miljøet. Jern finnes vanligvis i en stort sett uløselig jernform. Videre kan for høye nivåer av jern være giftige for P. aeruginosa . For å overvinne dette og regulere riktig inntak av jern, bruker P. aeruginosa sideroforer , som utskilles molekyler som binder og transporterer jern. Disse jern-siderofor-kompleksene er imidlertid ikke spesifikke. Bakterien som produserte sideroforene får ikke nødvendigvis den direkte fordelen med jerninntak. Snarere er det like sannsynlig at alle medlemmer av mobilbefolkningen får tilgang til jern-sideroforkompleksene. Medlemmer av mobilbefolkningen som effektivt kan produsere disse sideroforene blir ofte referert til som samarbeidspartnere; medlemmer som produserer lite eller ingen sideroforer blir ofte referert til som juksere. Forskning har vist at samarbeidspartnere og juksere vokser sammen, samarbeidspartnere har redusert kondisjon, mens juksere øker kondisjonen. Omfanget av endring i kondisjon øker med økende jernbegrensning. Med en økning i kondisjon kan jukserne utkonkurrere samarbeidspartnerne; dette fører til en samlet nedgang i kondisjonen til gruppen, på grunn av mangel på tilstrekkelig sideroforproduksjon. Disse observasjonene antyder at å ha en blanding av samarbeidspartnere og juksere kan redusere den virulente naturen til P. aeruginosa .
Enzymer
LigD danner en underfamilie av DNA -ligasene . Disse har alle et LigDom/ligase -domene, men mange bakterielle LigDs har også separate polymerasedomener /PolDoms og nukleasedomener /NucDoms. I P. aeruginosa ' s fall nukleasen domener er N-terminus , og polymerasen domener er C-terminus , forlengelser av enkelt sentral ligase domene.
Patogenese
P. aeruginosa er et opportunistisk , nosokomielt patogen for immunkompromitterte individer, og infiserer vanligvis luftveier, urinveier , brannskader og sår , og forårsaker også andre blodinfeksjoner .
| Infeksjoner | Detaljer og vanlige assosiasjoner | Høyrisikogrupper |
|---|---|---|
| Lungebetennelse | Diffus bronkopneumoni | Cystisk fibrose , ikke-CF bronkiektasi pasientene |
| Septisk sjokk | Assosiert med en lilla-svart hudlesjon ecthyma gangrenosum | Nøytropene pasienter |
| Urinveisinfeksjon | Urinveis kateterisering | |
| Gastrointestinal infeksjon | Nekrotiserende enterokolitt | Premature spedbarn og nøytropene kreftpasienter |
| Hud- og bløtvevsinfeksjoner | Blødning og nekrose | Personer med brannskader eller sårinfeksjoner |
Det er den vanligste årsaken til infeksjoner av brannskader og ytre øre ( otitis externa ), og er den hyppigste kolonisereren av medisinsk utstyr (f.eks. Katetre ). Pseudomonas kan spres med utstyr som blir forurenset og ikke er skikkelig rengjort eller på hendene til helsepersonell. Pseudomonas kan i sjeldne tilfeller forårsake samfunnservervede pneumonier , samt respiratorassosierte pneumonier, og er en av de vanligste midlene som er isolert i flere studier. Pyocyanin er en virulensfaktor for bakteriene og har vært kjent for å forårsake død hos C. elegans ved oksidativt stress . Imidlertid, salisylsyre kan hemme pyocyanin produksjon. En av ti sykehuservervede infeksjoner er fra Pseudomonas . Cystisk fibrose -pasienter er også disponert for P. aeruginosa -infeksjon i lungene på grunn av et funksjonelt tap i kloridionbevegelse over cellemembraner som følge av en mutasjon . P. aeruginosa kan også være en vanlig årsak til "badestamp-utslett" ( dermatitt ), forårsaket av mangel på riktig, periodisk oppmerksomhet på vannkvaliteten. Siden disse bakteriene trives i fuktige miljøer, for eksempel boblebad og svømmebassenger, kan de forårsake utslett eller svømmerøre. Pseudomonas er også en vanlig årsak til postoperativ infeksjon hos pasienter med radial keratotomi . Organismen er også assosiert med hudlesjonen ecthyma gangrenosum . P. aeruginosa er ofte assosiert med osteomyelitt som involverer punkteringssår i foten, antatt å skyldes direkte inokulering med P. aeruginosa via skumpolstringen som finnes i tennissko, med diabetespasienter med høyere risiko.
En komparativ genomisk analyse av 494 konkurrerende Pseudomonas -genomer, inkludert 189 komplette P. aeruginosa -genomer, identifiserte flere proteiner som deles av de aller fleste P. aeruginosa -stammer, men blir ikke observert i andre analyserte Pseudomonas -genomer. Faktisk er disse aeruginosa-spesifikke kjerneproteinene, som CntL, CntM, PlcB, Acp1, MucE, SrfA, Tse1, Tsi2, Tse3 og EsrC kjent for å spille en viktig rolle i denne artens patogenitet.
Giftstoffer
P. aeruginosa bruker virulensfaktoren eksotoksin A for å inaktivere eukaryotisk forlengelsesfaktor 2 via ADP-ribosylering i vertscellen, omtrent som difteritoksinet gjør. Uten forlengelsesfaktor 2 kan ikke eukaryote celler syntetisere proteiner og nekrotisere. Frigjøring av intracellulært innhold induserer en immunologisk respons hos immunkompetente pasienter. I tillegg bruker P. aeruginosa et eksoenzym, ExoU, som bryter ned plasmamembranen til eukaryote celler, noe som fører til lysis . I økende grad blir det anerkjent at den jernoppkjøpende sideroforen , pyoverdin , også fungerer som et toksin ved å fjerne jern fra mitokondrier og forårsake skade på denne organellen.
Fenasiner
Fenaziner er redoksaktive pigmenter produsert av P. aeruginosa . Disse pigmentene er involvert i quorum sensing , virulens og jerninnsamling. P. aeruginosa produserer flere pigmenter alle produsert av en biosyntetisk reaksjonsvei: pyocyanin , 1-hydroxyphenazine, fenazin-1-karboksamid, 5-metylfenazin-1-karboksylsyre-betain, og aeruginosin A. To operoner som er involvert i biosyntese fenazin: phzA1B1C1D1E1F1G1 og phzA2B2C2D2E2F2G2 . Disse operonene omdanner en chorisminsyre til fenazinene nevnt ovenfor. Tre nøkkelgener, phzH , phzM og phzS konverterer fenazin-1-karboksylsyre til fenazinene nevnt ovenfor. Selv fenazin biosyntese er godt studert, spørsmål gjenstår som den endelige strukturen i den brune fenazin pyomelanin.
Når pyocyaninbiosyntese inhiberes, observeres en nedgang i P. aeruginosa patogenitet in vitro . Dette antyder at pyocyanin er mest ansvarlig for den første koloniseringen av P. aeruginosa in vivo .
Utløsere
Med lave fosfatnivåer, P. aeruginosa har blitt funnet å aktivere fra godartet symbiont å uttrykke dødelige toksiner i tarmkanalen og føre til alvorlig skade eller drepe verten, som kan reduseres ved å tilveiebringe overskudd av fosfat i stedet for antibiotika.
Planter og virvelløse dyr
I høyere planter induserer P. aeruginosa myk råte , for eksempel i Arabidopsis thaliana (Thale karse) og Lactuca sativa (salat). Det er også sykdomsfremkallende for virvelløse dyr, inkludert nematoden Caenorhabditis elegans , fruktfluen Drosophila og møllen Galleria mellonella . Foreningene mellom virulensfaktorer er de samme for plante- og dyreinfeksjoner.
Kvorumfølelse
P. aeruginosa er et opportunistisk patogen med evnen til å koordinere genuttrykk for å konkurrere mot andre arter om næringsstoffer eller kolonisering. Regulering av genuttrykk kan skje gjennom celle-cellekommunikasjon eller quorum sensing (QS) via produksjon av små molekyler kalt autoinducers som slippes ut i det ytre miljøet. Disse signalene, når de når spesifikke konsentrasjoner korrelert med spesifikke populasjon celletettheter, aktiverer deres respektive regulatorer og endrer dermed genuttrykk og koordinerende atferd. P. aeruginosa bruker fem sammenkoblede QS -systemer - las, rhl, pqs, iqs og pch - som hver produserer unike signalmolekyler. las og rhl-systemer er ansvarlige for aktiveringen av mange QS-kontrollerte gener, pqs-systemet er involvert i kinolonsignalering og iqs-systemet spiller en viktig rolle i intercellulær kommunikasjon. QS i P. aeruginosa er organisert på en hierarkisk måte. På toppen av signalhierarkiet er las -systemet, siden las -regulatoren starter QS -reguleringssystemet ved å aktivere transkripsjonen av en rekke andre regulatorer, for eksempel rhl. Så, las -systemet definerer en hierarkisk QS -kaskade fra las til rhl -regulonene. Påvisning av disse molekylene indikerer at P. aeruginosa vokser som biofilm i lungene til pasienter med cystisk fibrose. Imidlertid er virkningen av QS og spesielt las -systemer på patogeniteten til P. aeruginosa uklar. Studier har vist at lasR-mangelfulle mutanter er assosiert med mer alvorlige utfall hos pasienter med cystisk fibrose og finnes hos opptil 63% av kronisk infiserte pasienter med cystisk fibrose til tross for nedsatt QS-aktivitet.
QS er kjent for å kontrollere uttrykk for en rekke virulensfaktorer på en hierarkisk måte, inkludert pigmentet pyocyanin. Selv om las -systemet initierer reguleringen av genuttrykket, fører dets fravær imidlertid ikke til tap av virulensfaktorene. Nylig har det blitt demonstrert at rhl-systemet delvis kontrollerer las-spesifikke faktorer, for eksempel proteolytiske enzymer som er ansvarlige for elastolytiske og stafylolytiske aktiviteter, men på en forsinket måte. Så las er en direkte og indirekte regulator av QS-kontrollerte gener. En annen form for genregulering som gjør at bakteriene raskt kan tilpasse seg endringer i omgivelsene, er gjennom miljøsignalering. Nyere studier har oppdaget at anaerobiose kan påvirke den store reguleringskretsen for QS betydelig. Denne viktige koblingen mellom QS og anaerobiose har en betydelig innvirkning på produksjonen av virulensfaktorer i denne organismen. Hvitløk blokkerer eksperimentelt quorum -sensing i P. aeruginosa .
Biofilmdannelse og syklisk di-GMP
Som i de fleste gramnegative bakterier reguleres dannelsen av P. aeruginosa biofilm av ett enkelt molekyl: syklisk di-GMP . Ved lav syklisk di-GMP konsentrasjon har P. aeruginosa en livsvarm livsmodus . Men når sykliske di-GMP-nivåer øker, begynner P. aeruginosa å etablere sittende lokalsamfunn på overflater. Den intracellulære konsentrasjonen av syklisk di-GMP øker i løpet av sekunder når P. aeruginosa berører en overflate ( f.eks . En stein, plast, vertsvev ...). Dette aktiverer produksjonen av klebrig pili, som fungerer som "ankre" for å stabilisere festingen av P. aeruginosa på overflaten. På senere stadier vil bakterier begynne å feste seg irreversibelt ved å produsere en sterkt limmatrise. Samtidig undertrykker syklisk di-GMP syntesen av flagellmaskineriet og forhindrer P. aeruginosa i å svømme. Ved undertrykkelse er biofilmene mindre vedheftende og lettere å behandle. Den biofilm matrise av P. aeruginosa er sammensatt av nukleinsyrer, aminosyrer, karbohydrater og forskjellige ioner. Det beskytter mekanisk og kjemisk P. aeruginosa mot aggresjon av immunsystemet og noen giftige forbindelser. P. aeruginosa biofilms matrise består av 2 typer sukker (eller "exopolysacharides") kalt PSL og PEL:
- Polysakkaridsynteselokus (PSL) og syklisk di-GMP danner en positiv tilbakemeldingssløyfe. PSL stimulerer syklisk di-GMP-produksjon, mens høy syklisk di-GMP slår på operonet og øker aktiviteten til operonet. Denne 15-geners operon er ansvarlig for celle-celle og celle-overflate-interaksjoner som kreves for cellekommunikasjon. Det er også ansvarlig for sekvestrering av den ekstracellulære polymere substansmatrisen.
- PEL er et kationisk eksopolysakkarid som kryssbinder ekstracellulært DNA i biofilmmatrisen P. aeruginosa .
Ved visse tegn eller påkjenninger, vender P. aeruginosa biofilmprogrammet tilbake og kobles fra. Nyere studier har vist at de spredte cellene fra P. aeruginosa biofilmer har lavere sykliske di-GMP nivåer og forskjellige fysiologier fra planktoniske og biofilmceller. Slike dispergerte celler er funnet å være svært virulente mot makrofager og C. elegans , men svært følsomme overfor jernstress, sammenlignet med planktoniske celler.
Biofilm og behandlingsresistens
Biofilm av P. aeruginosa kan forårsake kroniske opportunistiske infeksjoner , som er et alvorlig problem for medisinsk behandling i industrialiserte samfunn, spesielt for immunkompromitterte pasienter og eldre. De kan ofte ikke behandles effektivt med tradisjonell antibiotikabehandling . Biofilm ser ut til å beskytte disse bakteriene mot ugunstige miljøfaktorer. P. aeruginosa kan forårsake nosokomielle infeksjoner og regnes som en modellorganisme for studier av antibiotikaresistente bakterier. Forskere anser det som viktig å lære mer om de molekylære mekanismene som forårsaker overgangen fra planktonisk vekst til en biofilmfenotype og om QS rolle i behandlingsresistente bakterier som P. aeruginosa . Dette skal bidra til bedre klinisk behandling av kronisk infiserte pasienter, og bør føre til utvikling av nye legemidler.
Nylig har forskere undersøkt det mulige genetiske grunnlaget for P. aeruginosa -resistens mot antibiotika som tobramycin . Et sted identifisert som en viktig genetisk determinant for resistensen i denne arten er ndvB , som koder for periplasmatiske glukaner som kan samhandle med antibiotika og få dem til å bli sekvestrert i periplasma. Disse resultatene antyder at det eksisterer et genetisk grunnlag bak bakteriell antibiotikaresistens, i stedet for at biofilmen bare fungerer som en diffusjonsbarriere for antibiotika.
Diagnose
Avhengig av infeksjonens art, samles en passende prøve og sendes til et bakteriologilaboratorium for identifisering. Som med de fleste bakteriologiske prøver utføres en Gram-flekk , som kan vise gramnegative stenger og/eller hvite blodlegemer . P. aeruginosa produserer kolonier med en karakteristisk "druelignende" eller "fersk tortilla" lukt på bakteriologiske medier. I blandede kulturer kan den isoleres som klare kolonier på MacConkey agar (da den ikke gjærer laktose ) som vil teste positivt for oksidase . Bekreftende tester inkluderer produksjon av det blågrønne pigmentet pyocyanin på cetrimidagar og vekst ved 42 ° C. En TSI -skråning brukes ofte for å skille ikke -fermenterende Pseudomonas -arter fra enteriske patogener i fekale prøver.
Når P. aeruginosa isoleres fra et normalt sterilt sted (blod, bein, dype samlinger), anses det generelt som farlig, og krever nesten alltid behandling. Imidlertid er P. aeruginosa ofte isolert fra ikke -sterile steder (munnpinner, sputum , etc.), og under disse omstendighetene kan det representere kolonisering og ikke infeksjon. Isolering av P. aeruginosa fra ikke -sterile prøver bør derfor tolkes forsiktig, og råd fra en mikrobiolog eller smittsomme lege/apotek bør søkes før behandling påbegynnes. Ofte er det ikke nødvendig med behandling.
Identifikasjon
| Test | Resultater |
|---|---|
| Gram Stain | - |
| Oksidase | + |
| Indolproduksjon | - |
| Metylrød | - |
| Voges-Proskauer | - |
| Sitrat | + |
| Hydrogensulfidproduksjon | - |
| Ureahydrolyse | - |
| Fenylalanindeaminase | - |
| Lysin dekarboksylase | - |
| Motilitet | + |
| Gelatinhydrolyse | + |
| syre fra laktose | - |
| syre fra glukose | + |
| syre fra maltose | - |
| syre fra mannitol | + |
| syre fra sukrose | - |
| nitratreduksjon | + |
| DNAse | - |
| Lipase | + |
| Pigment | + (blåaktig grønn pigmentering) |
| Catalase | + |
| Hemolyse | Beta/variabel |
P. aeruginosa er en gramnegativ, aerob (og til tider fakultativt anaerob ), stavformet bakterie med unipolar motilitet . Det er blitt identifisert som et opportunistisk patogen for både mennesker og planter. P. aeruginosa er typen art av slekten Pseudomonas .
Identifisering av P. aeruginosa kan være komplisert av det faktum at individuelle isolater ofte mangler motilitet. Videre endrer mutasjoner i genet lasR drastisk kolonimorfologi og fører vanligvis til manglende hydrolysering av gelatin eller hemolyse.
Under visse forhold kan P. aeruginosa utskille en rekke pigmenter, inkludert pyocyanin (blå), pyoverdin (gul og fluorescerende ), pyorubin (rød) og pyomelanin (brun). Disse kan brukes til å identifisere organismen.
Klinisk identifisering av P. aeruginosa kan omfatte identifisering av produksjonen av både pyocyanin og fluorescein, samt dets evne til å vokse ved 42 ° C. P. aeruginosa er i stand til å vokse i diesel- og jetbrensel , der det er kjent som en hydrokarbon -brukende mikroorganisme , noe som forårsaker mikrobiell korrosjon . Det skaper mørke, gulaktige matter som noen ganger feilaktig kalles " alger " på grunn av deres utseende.
Behandling
Mange P. aeruginosa -isolater er resistente mot et stort utvalg av antibiotika og kan vise ytterligere resistens etter mislykket behandling. Det bør vanligvis være mulig å veilede behandlingen i henhold til laboratoriefølsomhet, i stedet for å velge et antibiotikum empirisk . Hvis antibiotika startes empirisk, bør det gjøres alt for å skaffe kulturer (før administrering av den første dosen antibiotika), og valget av antibiotika som skal brukes, bør vurderes når kulturresultatene er tilgjengelige.

På grunn av utbredt resistens mot mange vanlige førstelinje antibiotika, ble karbapenemer , polymyksiner og mer nylig tigecyklin ansett for å være de foretrukne legemidlene; Det er imidlertid også rapportert om resistens mot disse stoffene. Til tross for dette blir de fortsatt brukt i områder der det ennå ikke er rapportert motstand. Bruk av β-laktamasehemmere som sulbaktam er blitt anbefalt i kombinasjon med antibiotika for å øke den antimikrobielle virkningen selv i nærvær av et visst nivå av resistens. Kombinasjonsterapi etter grundig antimikrobiell følsomhetstesting har vist seg å være det beste tiltaket for behandling av multiresistent P. aeruginosa . Noen neste generasjons antibiotika som er rapportert å være aktive mot P. aeruginosa inkluderer doripenem, ceftobiprol og ceftaroline. Disse krever imidlertid flere kliniske studier for standardisering. Derfor er forskning for oppdagelse av nye antibiotika og legemidler mot P. aeruginosa svært nødvendig. Antibiotika som kan ha aktivitet mot P. aeruginosa inkluderer:
- aminoglykosider ( gentamicin , amikacin , tobramycin , men ikke kanamycin )
- kinoloner ( ciprofloxacin , levofloxacin , men ikke moxifloxacin )
-
cefalosporiner ( ceftazidim , cefepim , cefoperazone , cefpirom , ceftobiprole , men ikke cefuroxim , cefotaxim , eller ceftriaxone )
 Eksempler på antibiotisk sensitivitetstesting av P. aeruginosa . Den disk diffusjon test (A) og MIC-test (B). P. aeruginosa er iboende resistent mot ampicillin/sulbaktam , tigecyklin og trimetoprim/sulfametoksazol (ingen bruddpunkter i bilde B).
Eksempler på antibiotisk sensitivitetstesting av P. aeruginosa . Den disk diffusjon test (A) og MIC-test (B). P. aeruginosa er iboende resistent mot ampicillin/sulbaktam , tigecyklin og trimetoprim/sulfametoksazol (ingen bruddpunkter i bilde B). - antipseudomonale penicilliner : karboksypenicilliner ( karbenicillin og ticarcillin ) og ureidopenicilliner ( mezlocillin , azlocillin og piperacillin ). P. aeruginosa er iboende resistent mot alle andre penicilliner .
- karbapenemer ( meropenem , imipenem , doripenem , men ikke ertapenem )
- polymyxiner ( polymyxin B og colistin )
- monobaktamer ( aztreonam )
Ettersom fluorokinoloner er en av få antibiotikaklasser som er meget effektive mot P. aeruginosa , er bruk på noen sykehus sterkt begrenset for å unngå utvikling av resistente stammer. I de sjeldne tilfellene hvor infeksjonen er overfladisk og begrenset (for eksempel øreinfeksjoner eller spikerinfeksjoner ), kan aktuelt gentamicin eller kolistin brukes.
For pseudomonale sårinfeksjoner kan eddiksyre med konsentrasjoner fra 0,5% til 5% være et effektivt bakteriostatisk middel for å eliminere bakteriene fra såret. Vanligvis plasseres en steril gasbind dynket med eddiksyre på såret etter vanning med vanlig saltvann. Å kle seg en gang om dagen. Pseudomonas elimineres vanligvis i 90% av tilfellene etter 10 til 14 dagers behandling.
Antibiotikaresistens
En av de mest bekymringsfulle egenskapene av P. aeruginosa er dets lave følsomhet overfor antibiotika, som kan henføres til en felles virkning av flermedisin efflukspumpene med kromosomalt kodet antibiotiske resistensgener (f.eks mexAB , mexxy , etc.) og den lave permeabilitet av bakterie mobilkonvolutter. I tillegg til denne iboende motstanden, utvikler P. aeruginosa lett ervervet resistens enten ved mutasjon i kromosomkodede gener eller ved horisontal genoverføring av antibiotikaresistens determinanter. Utvikling av multiresistens av P. aeruginosa -isolater krever flere forskjellige genetiske hendelser, inkludert anskaffelse av forskjellige mutasjoner og/eller horisontal overføring av antibiotikaresistensgener. Hypermutasjon favoriserer valg av mutasjonsdrevet antibiotikaresistens i P. aeruginosa- stammer som produserer kroniske infeksjoner, mens gruppering av flere forskjellige antibiotikaresistensgener i integroner favoriserer samordnet oppkjøp av antibiotikaresistens-determinanter. Noen nylige studier har vist fenotypisk resistens assosiert med dannelse av biofilm eller fremveksten av varianter av små kolonier kan være viktige i responsen fra P. aeruginosa- populasjoner til antibiotikabehandling .
Det er funnet at mekanismer som ligger til grunn for antibiotikaresistens inkluderer produksjon av antibiotika-nedbrytende eller antibiotisk inaktiverende enzymer, ytre membranproteiner for å kaste ut antibiotika og mutasjoner for å endre antibiotikamål. Tilstedeværelse av antibiotika-nedbrytende enzymer som utvidet spektrum β-laktamaser som PER-1, PER-2, VEB-1, AmpC cefalosporinaser, karbapenemaser som serinoksacillinaser, metallo-b-laktamaser, OXA-type karbapenemaser, aminoglykosidmodifiserende enzymer , blant andre har blitt rapportert. P. aeruginosa kan også modifisere målene for antibiotisk virkning, for eksempel metylering av 16S rRNA for å forhindre aminoglykosidbinding og modifikasjon av DNA, eller topoisomerase for å beskytte det mot kinoloners virkning. P. aeruginosa har også blitt rapportert å ha flere effluxpumpersystemer som gir resistens mot en rekke antibiotikaklasser og MexAB-OprM ( Resistance-nodulation-division ( RND ) -familien) regnes som den viktigste . En viktig faktor som er funnet å være assosiert med antibiotikaresistens er nedgangen i virulensegenskapene til den resistente stammen. Slike funn er rapportert når det gjelder rifampicinresistente og kolistinresistente stammer, der reduksjon i infeksjonsevne, quorumføling og motilitet er dokumentert.
Mutasjoner i DNA -gyrase er vanligvis forbundet med antibiotikaresistens hos P. aeruginosa . Disse mutasjonene, når de kombineres med andre, gir høy motstand uten å hindre overlevelse. I tillegg kan gener involvert i syklisk-di-GMP-signalering bidra til resistens. Når de vokser in vitro -forhold designet for å etterligne lungene til en cystisk fibrose -pasient, muterer disse genene gjentatte ganger.
To små RNA : Sr0161 og ErsA ble vist å samhandle med mRNA som koder for hovedporin OprD som er ansvarlig for opptaket av karbapenem antibiotika i periplasma . SRNA binder seg til 5'UTR av oprD og forårsaker økning i bakteriell resistens mot meropenem . En annen sRNA: Sr006 ble foreslått for å positivt regulere (post-transkripsjonelt) uttrykket av PagL, et enzym som er ansvarlig for deacylering av lipid A. Dette reduserer den pro-inflammatoriske egenskapen til lipid A. Videre på samme måte som å studere Salmonella Sr006 regulering av PagL. uttrykk ble foreslått for å hjelpe mot polymyxin B -resistens.
Forebygging
Probiotisk profylakse kan forhindre kolonisering og forsinke utbruddet av Pseudomonas -infeksjon i en ICU -setting. Immunoprofylakse mot Pseudomonas blir undersøkt. Risikoen for å pådra seg P. aeruginosa kan reduseres ved å unngå bassenger, boblebad og andre stående vann. regelmessig desinfisering og/eller utskifting av utstyr som regelmessig møter fuktighet (for eksempel kontaktlinser og løsninger); og vaske hendene ofte (som også er beskyttende mot mange andre patogener). Selv den beste hygienepraksis kan imidlertid ikke beskytte et individ helt mot P. aeruginosa, gitt hvor vanlig P. aeruginosa er i miljøet.
Eksperimentelle terapier
Fagterapi mot P. aeruginosa har blitt undersøkt som en mulig effektiv behandling, som kan kombineres med antibiotika, har ingen kontraindikasjoner og minimale bivirkninger. Fager produseres som steril væske, egnet for inntak, applikasjoner etc. Fagterapi mot øreinfeksjoner forårsaket av P. aeruginosa ble rapportert i tidsskriftet Clinical Otolaryngology i august 2009.
Forskning
I 2013 beskrev João Xavier et eksperiment der P. aeruginosa , da den ble utsatt for gjentatte runder med betingelser der den trengte å sverme for å skaffe seg mat, utviklet evnen til å "oversvarmes" i hastigheter 25% raskere enn opprinnelige organismer, ved å utvikle flere flagella , mens den opprinnelige organismen har et enkelt flagellum. Dette resultatet var bemerkelsesverdig innen eksperimentell evolusjon ved at det var svært repeterbart.
P. aeruginosa har blitt studert for bruk i bioremediering og bruk i behandling av polyetylen i kommunalt fast avfall .
Se også
Referanser
- Breidenstein EB, de la Fuente-Núñez C, Hancock RE (august 2011). "Pseudomonas aeruginosa: alle veier fører til motstand". Trender innen mikrobiologi . 19 (8): 419–26. doi : 10.1016/j.tim.2011.04.005 . PMID 21664819 .
Eksterne linker
- Type stamme av Pseudomonas aeruginosa ved Bac Dive - Metadatabase for bakteriell mangfold
- Johanna M. Sweere et al. (2019): Bakteriofag utløser antiviral immunitet og forhindrer klarering av bakteriell infeksjon , Science 29 Mar 2019: Vol. 363, utgave 6434, eaat9691. doi: 10.1126/science.aat9691 om Pseudomonas aeruginosa filamentøse fager (Pf-phages), Inoviridae . Se også:
- UM -forskere publiserer nye funn om bakterielle virus . På: EurekAlert! 1. april 2019. Kilde: University of Montana