Arvelig hemorragisk telangiektasi - Hereditary hemorrhagic telangiectasia
| Arvelig hemoragisk telangiectasia | |
|---|---|
 | |
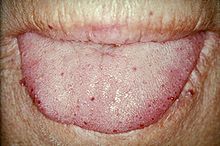
| Karakteristiske leppe -telangiektaser. | |
| Spesialitet | Medisinsk genetikk , gastroenterologi |
| Symptomer | Neseblod , gastrointestinal blødning |
Arvelig hemoragisk telangiectasia ( HHT ), også kjent som Osler - Weber - Rendu sykdom og Osler - Weber - Rendu syndrom , er en sjelden autosomal dominerende genetisk lidelse som fører til unormal dannelse av blodkar i huden , slimhinner og ofte i slike organer som lungene , leveren og hjernen .
Det kan føre til neseblod , akutt og kronisk blødning i fordøyelseskanalen og forskjellige problemer på grunn av involvering av andre organer. Behandlingen fokuserer på å redusere blødning fra blodkarlesjoner, og noen ganger kirurgi eller andre målrettede inngrep for å fjerne arteriovenøse misdannelser i organer. Kronisk blødning krever ofte jerntilskudd og noen ganger blodoverføringer . HHT overføres på en autosomal dominerende måte, og forekommer hos én av 5000–8000 mennesker i Nord -Amerika.
Sykdommen bærer navnene til Sir William Osler , Henri Jules Louis Marie Rendu og Frederick Parkes Weber , som beskrev den på slutten av 1800- og begynnelsen av 1900 -tallet.
Tegn og symptomer
Telangiectasias
Telangiectasia (små vaskulære misdannelser) kan forekomme i hud og slimhinner i nesen og mage -tarmkanalen. Det vanligste problemet er neseblod (epistaxis), som skjer ofte fra barndommen og påvirker omtrent 90–95% av mennesker med HHT. Lesjoner på huden og i munnen bløder sjeldnere, men kan betraktes som kosmetisk ubehagelige; de påvirker omtrent 80%. Hudlesjonene forekommer karakteristisk på leppene , nesen og fingrene og på ansiktets hud i soleksponerte områder. De dukker opp plutselig, og antallet øker over tid.
Rundt 20% er påvirket av symptomatiske lesjoner i fordøyelseskanalen, selv om en høyere prosentandel har lesjoner som ikke forårsaker symptomer. Disse lesjonene kan blø periodisk, noe som sjelden er signifikant nok til å bli lagt merke til (i form av blodig oppkast eller svart avføring ), men kan til slutt føre til tømming av jern i kroppen, noe som kan resultere i jernmangelanemi .
Arteriovenøs misdannelse
Arteriovenøse misdannelser (AVM, større vaskulære misdannelser) forekommer i større organer, hovedsakelig lungene ( pulmonale AVM ) (50%), lever (30-70%) og hjernen ( cerebral AVM , 10%), med en svært liten andel ( <1%) av AVM i ryggmargen .
Vaskulære misdannelser i lungene kan forårsake en rekke problemer. Lungene "filtrerer" vanligvis ut bakterier og blodpropper fra blodet; AVM -er omgår lungens kapillærnettverk og lar disse migrere til hjernen, hvor bakterier kan forårsake en hjerneabces og blodpropper kan føre til hjerneslag . HHT er den vanligste årsaken til lunge -AVM: 70–80% av alle mennesker som har lunge -AVM, skyldes HHT. Blødning fra lunge -AVM er relativt uvanlig, men kan forårsake hemoptyse (hoste opp blod) eller hemothorax (blod akkumuleres i brysthulen). Store vaskulære misdannelser i lungen tillater oksygenfattig blod fra høyre ventrikkel å omgå alveolene , noe som betyr at dette blodet ikke har mulighet til å absorbere ferskt oksygen. Dette kan føre til andpustenhet . Store AVM kan føre til platypné , pustevansker som er mer markert når du sitter oppe sammenlignet med å ligge; dette gjenspeiler sannsynligvis endringer i blodstrømmen forbundet med posisjonering. Svært store AVM -er forårsaker en markert manglende evne til å absorbere oksygen, noe som kan merkes av cyanose (blåaktig misfarging av lepper og hud), klumping av neglene (ofte påvist ved kronisk lave oksygennivåer) og en brummende støy over den berørte delen av lungen påviselig med stetoskop .
Symptomene produsert av AVM i leveren avhenger av hvilken type unormal forbindelse de danner mellom blodårene. Hvis forbindelsen er mellom arterier og vener , omgår en stor mengde blod kroppens organer, som hjertet kompenserer for ved å øke hjerteeffekten . Etter hvert utvikler kongestiv hjertesvikt (" hjertesvikt med høy effekt"), med andpustenhet og benhevelse blant andre problemer. Hvis AVM skaper en forbindelse mellom portalvenen og blodårene i leveren, kan resultatet være portalhypertensjon (økt portalvenetrykk), der det dannes kollaterale blodkar i spiserøret ( esophageal varices ), som kan bløde voldsomt; Videre kan det økte trykket gi opphav til væskeansamling i bukhulen ( ascites ). Hvis strømmen i AVM er i den andre retningen, strømmer portalvenøst blod direkte inn i venene i stedet for å løpe gjennom leveren; dette kan føre til hepatisk encefalopati (forvirring på grunn av portalavfall som irriterer hjernen). Sjelden blir gallegangene fratatt blod, noe som fører til alvorlig kolangitt (betennelse i gallegangene). Lever -AVM er påviselig hos over 70% av mennesker med HHT, men bare 10% opplever problemer som et resultat.
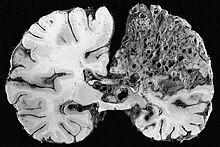
I hjernen utøver AVM av og til trykk, noe som fører til hodepine . De kan også øke risikoen for anfall , i likhet med unormalt vev i hjernen. Til slutt kan blødning fra en AVM føre til intracerebral blødning (blødning i hjernen), noe som forårsaker noen av symptomene på slag som svakhet i en del av kroppen eller vanskeligheter med å snakke. Hvis blødningen skjer i det subaraknoidale rommet ( subaraknoid blødning ), er det vanligvis alvorlig, plutselig hodepine og redusert bevissthetsnivå og ofte svakhet i deler av kroppen.
Andre problemer
En veldig liten andel (de som er påvirket av SMAD4 (MADH4) mutasjoner, se nedenfor) har flere godartede polypper i tykktarmen , som kan blø eller forvandle seg til tykktarmskreft . En tilsvarende liten andel opplever pulmonal hypertensjon , en tilstand der trykket i lungearteriene økes, utøver trykk på høyre side av hjertet og forårsaker perifert ødem (hevelse i bena), besvimelse og angrep av brystsmerter . Det har blitt observert at risikoen for trombose (spesielt venetrombose , i form av dyp venetrombose eller lungeemboli ) kan øke. Det er en mistanke om at de med HHT kan ha en mild immunsvikt og derfor har en litt økt risiko for infeksjoner.
Genetikk
HHT er en genetisk lidelse med et autosomalt dominerende arvemønster. De med HHT -symptomer som ikke har slektninger med sykdommen, kan ha en ny mutasjon. Homozygositet ser ut til å være dødelig i livmoren.
Fem genetiske typer HHT gjenkjennes. Av disse har tre blitt knyttet til bestemte gener , mens de to gjenværende foreløpig bare har vært knyttet til et bestemt sted . Mer enn 80% av alle tilfeller av HHT skyldes mutasjoner i enten ENG eller ACVRL1 . Totalt er det kjent over 600 forskjellige mutasjoner. Det er sannsynligvis en overvekt av begge typer i bestemte populasjoner, men dataene er motstridende. MADH4- mutasjoner, som forårsaker tykktarmspolypose i tillegg til HHT, utgjør omtrent 2% av sykdomsfremkallende mutasjoner. Bortsett fra MADH4 er det ikke klart om mutasjoner i ENG og ACVRL1 fører til spesielle symptomer, selv om noen rapporter tyder på at ENG -mutasjoner er mer sannsynlig å forårsake lungeproblemer mens ACVRL1 -mutasjoner kan forårsake flere leverproblemer, og pulmonal hypertensjon kan være et spesielt problem hos mennesker med ACVRL1 -mutasjoner. Personer med nøyaktig de samme mutasjonene kan ha ulik karakter og alvorlighetsgrad av symptomene, noe som tyder på at flere gener eller andre risikofaktorer kan avgjøre hastigheten med lesjoner. disse er ennå ikke identifisert.
| Navn | OMIM | Gene | Lokus | Beskrivelse |
|---|---|---|---|---|
| HHT1 | 187300 | ENG | 9 q34.1 | ENG koder for endoglin, en reseptor for TGF-β1 ( transformerende vekstfaktor beta 1 ) og TGF-β3 ; den genetiske koblingen ble identifisert i 1994. Det er observert en høy andel rammeskiftmutasjoner . Nesten alle mutasjoner forekommer i den ekstracellulære delen av proteinet (delen som sitter på overflaten av cellen ). |
| HHT2 | 600376 | ACVRL1 | 12 q11-q14 | ACVRL1 koder for Alk-1 ( ACVR1 , activin reseptorlignende kinase 1), en TGF-β1 reseptor; genetisk kobling ble identifisert i 1996. |
| HHT3 | 601101 | Ukjent | 5 q31 | Funksjon ukjent, kobling identifisert i 2005. |
| HHT4 | 610655 | Ukjent | 7 s14 . | Funksjon ukjent, kobling identifisert i 2006. |
| JPHT | 175050 | MADH4 | 18 q21.1 | MADH4 koder for SMAD4, et intracellulært signalprotein for TGF -superfamiliereseptorene. Mutasjoner i dette genet forårsaker HHT og juvenil polypose. Kobling ble identifisert i 2004. Mutasjoner hovedsakelig i eksonene 8–11, ofte de novo (nyervervet, ikke arvet). |
Patofysiologi

Telangiectasias og arteriovenøse misdannelser i HHT antas å oppstå på grunn av endringer i angiogenese , utvikling av blodkar ut av eksisterende. Utviklingen av et nytt blodkar krever aktivering og migrering av forskjellige typer celler, hovedsakelig endotel , glatt muskel og pericytter . Den eksakte mekanismen som HHT-mutasjonene påvirker denne prosessen er ennå ikke klar, og det er sannsynlig at de forstyrrer balansen mellom pro- og antiangiogene signaler i blodkar. Veggen av telangiectasias er uvanlig sprø , noe som forklarer tendensen til disse lesjonene til å blø.
Alle gener som hittil er kjent for å være knyttet til HHT-kode for proteiner i TGF-β-signalveien . Dette er en gruppe proteiner som deltar i signaloverføring av hormoner av den transformerende vekstfaktor beta-superfamilien (den transformerende vekstfaktor beta , benmorfogent protein og vekstdifferensieringsfaktor -timer), spesielt BMP9 / GDF2 og BMP10 . Hormonene kommer ikke inn i cellen, men lenker til reseptorer på cellemembranen; disse aktiverer deretter andre proteiner, og påvirker til slutt mobil oppførsel på en rekke måter, for eksempel mobil overlevelse, spredning (økning i antall) og differensiering (blir mer spesialisert). For at hormonsignalet skal transduser tilstrekkelig, er det nødvendig med en kombinasjon av proteiner: to hver av to typer serin/ treoninspesifikke kinasetype- membranreseptorer og endoglin. Når de er bundet til hormonet, type II-reseptorproteiner fosforylere (overføring fosfat ) på type I-reseptorproteiner (hvorav Alk-1 er en), som i sin tur fosforylerer et kompleks av Smad proteiner (hovedsakelig Smad 1 , SMAD5 og SMAD8 ). Disse binder seg til SMAD4 og migrerer til cellekjernen der de fungerer som transkripsjonsfaktorer og deltar i transkripsjonen av bestemte gener. I tillegg til SMAD -banen virker membranreseptorene også på MAPK -banen , som har ytterligere handlinger på cellers oppførsel. Både Alk-1 og endoglin uttrykkes hovedsakelig i endotel, og forklarer kanskje hvorfor HHT-forårsakende mutasjoner i disse proteinene hovedsakelig fører til problemer med blodkar. Både ENG og ACVRL1 mutasjoner fører hovedsakelig til underproduksjon av de beslektede proteinene, i stedet for feilfunksjon av proteinene.
Diagnose
Diagnostiske tester kan utføres av forskjellige årsaker. For det første er det nødvendig med noen tester for å bekrefte eller tilbakevise diagnosen. For det andre er det nødvendig med noen for å identifisere eventuelle komplikasjoner.
Telangiectasias
Huden og munnhulen telangiectasias er visuelt identifiserbare ved fysisk undersøkelse , og på samme måte kan lesjonene i nesen sees på endoskopi av nasopharynx eller på laryngoskopi . Alvorligheten av neseblod kan kvantifiseres objektivt ved hjelp av et rutenettlignende spørreskjema der antall neseblødningsepisoder og varighet registreres.
Fordøyelseskanalens telangiektasi kan identifiseres ved esophagogastroduodenoscopy (endoskopi av spiserøret, magen og første del av tynntarmen). Denne prosedyren vil vanligvis bare bli utført hvis det er anemi som er mer markert enn forventet av alvorligheten av neseblod, eller hvis det er tegn på alvorlig blødning (oppkast av blod, svart avføring). Hvis antallet lesjoner sett på endoskopi er uventet lavt, kan resten av tynntarmen undersøkes med kapselendoskopi , der pasienten svelger en kapselformet enhet som inneholder et miniatyrkamera som overfører bilder av fordøyelseskanalen til en bærbar digital opptaker.
Arteriovenøse misdannelser
Identifisering av AVM krever detaljert medisinsk avbildning av organene som oftest påvirkes av disse lesjonene. Ikke alle AVM -er forårsaker symptomer eller er i fare for å gjøre det, og derfor er det en viss variasjon mellom spesialister om hvorvidt slike undersøkelser vil bli utført, og av hvilken modalitet; ofte tas beslutninger om dette spørsmålet sammen med pasienten.
Lunge AVM kan mistenkes på grunn av unormalt utseende av lungene på røntgen av brystet , eller hypoksi (lave oksygennivåer) ved pulsoksymetri eller arteriell blodgassbestemmelse . Boblekontrast ekkokardiografi (bobleeko) kan brukes som et screeningsverktøy for å identifisere unormale forbindelser mellom lungearteriene og venene . Dette innebærer injeksjon av opphisset saltvann i en vene, etterfulgt av ultralydbasert avbildning av hjertet. Normalt fjerner lungene små luftbobler fra sirkulasjonen, og de sees derfor bare i høyre forkammer og høyre ventrikkel . Hvis det er en AVM, vises bobler i venstre atrium og venstre ventrikkel , vanligvis 3–10 hjertesykluser etter høyre side; dette er langsommere enn ved hjertefeil , der det er direkte forbindelser mellom høyre og venstre side av hjertet. Et større antall bobler er mer sannsynlig å indikere tilstedeværelsen av en AVM. Bubble echo er ikke et perfekt screeningsverktøy, ettersom det kan gå glipp av mindre AVM -er og ikke identifisere stedet for AVM -er. Ofte motsetning -enhanced beregnet tomografi (CT-angiografi) blir brukt til å identifisere lungelesjoner; denne modaliteten har en følsomhet på over 90%. Det kan være mulig å utelate kontrastadministrasjon på moderne CT -skannere. Ekkokardiografi brukes også hvis det er mistanke om pulmonal hypertensjon eller hjertesvikt med høy effekt på grunn av store leverskader, noen ganger etterfulgt av hjertekateterisering for å måle trykket inne i hjertets forskjellige kamre.
Lever AVM kan mistenkes på grunn av unormale leverfunksjonstester i blodet, fordi symptomene på hjertesvikt utvikler seg, eller på grunn av gulsott eller andre symptomer på leverdysfunksjon. Den mest pålitelige første screeningstesten er Doppler -ultralyd av leveren; dette har en veldig høy følsomhet for å identifisere vaskulære lesjoner i leveren. Om nødvendig kan kontrastforsterket CT brukes til å karakterisere AVMer ytterligere. Det er ekstremt vanlig å finne tilfeldige knuter på leverskanninger, oftest på grunn av fokal nodulær hyperplasi (FNH), da disse er hundre ganger ganger mer vanlige i HHT sammenlignet med befolkningen generelt. FNH regnes som ufarlig. Vanligvis brukes tumormarkører og ytterligere avbildningsmodeller for å skille mellom FNH og ondartede svulster i leveren. Leverbiopsi frarådes hos personer med HHT, da risikoen for blødning fra lever -AVM kan være betydelig. Leverskanning kan være nyttig hvis noen mistenkes for HHT, men ikke oppfyller kriteriene (se nedenfor) med mindre leverskader kan påvises.
Hjerne -AVM kan påvises ved computertomografi angiografi (CTA eller CT angio) eller magnetisk resonans angiografi (MRA); CTA er bedre i å vise fartøyene selv, og MRA gir flere detaljer om forholdet mellom en AVM og omkringliggende hjernevev. Generelt anbefales MR. Forskjellige typer vaskulære deformasjoner kan oppstå: AVMs, mikro-AVMs, telangiectasier og arteriovenøse fistler . Hvis det er planlagt kirurgi, embolisering eller annen behandling (se nedenfor), kan det være nødvendig med cerebral angiografi for å få tilstrekkelig detalj av karene. Denne prosedyren medfører en liten risiko for slag (0,5%) og er derfor begrenset til spesifikke omstendigheter. Nylige faglige retningslinjer anbefaler at alle barn med mistenkt eller bestemt HHT gjennomgår en MR -hjerne tidlig i livet for å identifisere AVM -er som kan forårsake store komplikasjoner. Andre antyder at screening for cerebral AVM sannsynligvis er unødvendig hos de som ikke opplever nevrologiske symptomer, fordi de fleste lesjoner som ble oppdaget ved screening av skanninger ikke ville kreve behandling, noe som ville skape uønskede gåter.
Genetisk testing
Genetiske tester er tilgjengelige for ENG , ACVRL1 og MADH4 mutasjoner. Testing er ikke alltid nødvendig for diagnose, fordi symptomene er tilstrekkelige til å skille sykdommen fra andre diagnoser. Det er situasjoner der testing kan være spesielt nyttig. For det første kan barn og unge voksne med en forelder med bestemt HHT ha begrensede symptomer, men likevel være utsatt for noen av komplikasjonene nevnt ovenfor; hvis mutasjonen er kjent hos den berørte forelder, ville fravær av denne mutasjonen hos barnet forhindre behovet for screeningstester. Videre kan genetisk testing bekrefte diagnosen hos de med begrensede symptomer som ellers ville ha blitt merket som "mulig HHT" (se nedenfor).
Genetisk diagnose ved HHT er vanskelig, ettersom mutasjoner forekommer på mange forskjellige steder i de koblede genene, uten at spesielle mutasjoner er svært hyppige (i motsetning til for eksempel ΔF508 -mutasjonen ved cystisk fibrose ). Sekvensanalyse av de involverte genene er derfor den mest nyttige tilnærmingen (følsomhet 75%), etterfulgt av ytterligere testing for å oppdage store slettinger og duplikasjoner (ytterligere 10%). Ikke alle mutasjoner i disse genene har vært knyttet til sykdom.
Mutasjoner i MADH4 -genet er vanligvis assosiert med juvenil polypose, og påvisning av en slik mutasjon vil indikere et behov for å skjerme pasienten og berørte slektninger for polypper og svulster i tykktarmen.
Kriterier
Diagnosen kan stilles avhengig av tilstedeværelsen av fire kriterier, kjent som " Curaçao -kriteriene". Hvis tre eller fire er oppfylt, har en pasient "bestemt HHT", mens to gir "mulig HHT":
- Spontan tilbakevendende epistaxis
- Flere telangiektasier på typiske steder (se ovenfor)
- Bevist visceral AVM (lunge, lever, hjerne, ryggrad)
- Førsteklasses familiemedlem med HHT
Til tross for betegnelsen "mulig", er det fortsatt ekstremt sannsynlig at noen med en visceral AVM og en familiehistorie, men uten neseblod eller telangiektasi, har HHT, fordi disse AVMene er svært uvanlige i befolkningen generelt. På samme tid kan det samme ikke sies om neseblod og sparsomme telangiektasier, som begge forekommer hos mennesker uten HHT, i fravær av AVM. Noens diagnostiske status kan endres i løpet av livet, ettersom små barn ennå ikke kan vise alle symptomene; i en alder av 16 er tretten prosent fremdeles ubestemt, mens de fleste (99%) i en alder av 60 år har en klar diagnostisk klassifisering. Barna til etablerte HHT -pasienter kan derfor merkes som "mulig HHT", da 50% kan vise seg å ha HHT i løpet av livet.
Behandling
Behandling av HHT er symptomatisk (den omhandler symptomene snarere enn selve sykdommen), da det ikke er noen terapi som stopper utviklingen av telangiektasi og AVM direkte. Videre brukes noen behandlinger for å forhindre utvikling av vanlige komplikasjoner. Kronisk neseblod og fordøyelseskanalblødning kan begge føre til anemi; hvis selve blødningen ikke kan stoppes helt, krever anemi behandling med jerntilskudd . De som ikke tåler jerntabletter eller -løsninger, kan kreve administrering av intravenøst jern og blodtransfusjon hvis anemi forårsaker alvorlige symptomer som garanterer rask forbedring av blodtallet.
De fleste behandlinger som brukes i HHT er beskrevet hos voksne, og erfaringen med å behandle barn er mer begrenset. Kvinner med HHT som blir gravide har en økt risiko for komplikasjoner, og blir observert nøye, selv om den absolutte risikoen fortsatt er lav (1%).
Neseblod
En akutt neseblod kan håndteres med en rekke tiltak, for eksempel pakking av nesehulen med absorberende vattpinner eller geler. Fjerning av pakningene etter blødningen kan føre til gjenåpning av skjøre kar, og derfor anbefales smurt eller atraumatisk pakning. Noen pasienter vil kanskje lære å pakke seg selv for å håndtere neseblod uten å måtte ty til medisinsk hjelp.
Hyppige neseblod kan delvis forhindres ved å holde neseborene fuktige, og ved å påføre saltoppløsning , kremer som inneholder østrogen eller tranexaminsyre ; disse har få bivirkninger og kan ha en liten fordel. En rekke ytterligere metoder har blitt brukt for å forhindre tilbakevendende blødning hvis enkle tiltak mislykkes. Medisinske behandlinger inkluderer oral tranexaminsyre og østrogen; det bevis for disse er relativt begrenset, og østrogen er dårlig tolerert av menn og muligens bærer risiko for kreft og hjertesykdom hos kvinner forbi overgangsalderen. Nesekoagulering og cauterisering kan redusere blødningen fra telangiektasi, og anbefales før operasjon vurderes. Imidlertid anbefales det på det sterkeste å bruke minst varme og tid for å forhindre septalperforeringer og overdreven traumer i neseslimhinnen som allerede er utsatt for blødning. Skleroterapi er et annet alternativ for å håndtere blødningen. Denne prosessen innebærer å injisere en liten mengde luftet irritasjon (vaskemiddel som natriumtetradecylsulfat) direkte i telangiektasiene. Vaskemiddelet får karet til å kollapse og herdes, noe som resulterer i arrvev. Dette er den samme prosedyren som brukes til å behandle åreknuter og lignende lidelser.
Det kan være mulig å embolisere vaskulære lesjoner gjennom intervensjonell radiologi ; dette krever at et kateter passeres gjennom en stor arterie og lokaliserer maksillærarterien under røntgenveiledning , etterfulgt av injeksjon i karet av partikler som lukker blodårene. Fordelen med prosedyren har en tendens til å være kortvarig, og den kan være mest hensiktsmessig i episoder med alvorlig blødning.
For mer effektivt å redusere tilbakefall og alvorlighetsgrad av epistaxis, kan andre alternativer brukes i forbindelse med behandlinger som er nevnt ovenfor. Intravenøst administrerte anti-VEGF-stoffer som bevacizumab (merkenavn Avastin), pazopinab og talidomid eller dets derivater forstyrrer produksjonen av nye blodårer som er svake og derfor utsatt for blødning. På grunn av tidligere erfaringer med å foreskrive talidomid til gravide for å lindre symptomer på kvalme og de forferdelige fødselsskadene som fulgte, er talidomid en siste utvei. I tillegg kan talidomid forårsake nevropati. Selv om dette kan dempes ved å tinke med doser og foreskrive derivater som lenolidomid og pomalidomid, foretrekker mange leger alternative VEGF -hemmere. Bevacizumab har vist seg å redusere alvorlighetsgraden av epistaxis uten bivirkninger.
Hvis andre inngrep har mislyktes, har flere operasjoner blitt rapportert å gi fordel. Den ene er septal dermoplasty eller Saunders prosedyre, der huden transplanteres inn i neseborene, og den andre er Youngs prosedyre, der neseborene er forseglet helt.
Hud og fordøyelseskanal
Hudlesjonene til HHT kan være skjemmende og kan svare på behandling med langpulsert Nd: YAG-laser . Hudskader i fingertuppene kan noen ganger blø og forårsake smerte. Hudtransplantasjon er tidvis nødvendig å behandle dette problemet.
Når det gjelder lesjoner i fordøyelseskanalen, behandles mild blødning og mild resulterende anemi med jerntilskudd, og det gis ingen spesifikk behandling. Det er begrensede data om hormonbehandling og tranexaminsyre for å redusere blødning og anemi. Alvorlig anemi eller episoder med alvorlig blødning behandles med endoskopisk argonplasmakoagulering (APC) eller laserbehandling av eventuelle identifiserte lesjoner; dette kan redusere behovet for støttende behandling. De forventede fordelene er ikke slik at det er anbefalt gjentatte forsøk på behandling av lesjoner. Plutselig, veldig alvorlig blødning er uvanlig - hvis det oppstår, må alternative årsaker (for eksempel magesår ) vurderes - men embolisering kan brukes i slike tilfeller.
Lungeavm
Lungeskader, når de er identifisert, blir vanligvis behandlet for å forhindre episoder med blødning og enda viktigere emboli i hjernen. Dette gjøres spesielt ved lesjoner med et blodkar på 3 mm eller større, ettersom disse er mest sannsynlig å forårsake langtidskomplikasjoner med mindre de blir behandlet. Den mest effektive strømterapien er embolisering med avtagbare metallspoler eller plugger. Prosedyren innebærer punktering av en stor vene (vanligvis under generell bedøvelse ), etterfulgt av fremføring av et kateter gjennom høyre ventrikkel og inn i lungearterien , hvoretter radiokontrast injiseres for å visualisere AVMene ( lungeangiografi ). Når lesjonen er identifisert, settes det ut spoler som hindrer blodstrømmen og lar lesjonen gå tilbake. I erfarne hender pleier prosedyren å være veldig effektiv og med begrensede bivirkninger, men lesjoner kan komme igjen og ytterligere forsøk kan være nødvendig. CTA -skanninger gjentas for å overvåke for gjentakelse. Kirurgisk eksisjon har nå i hovedsak blitt forlatt på grunn av suksessen med emboloterapi.
De med enten bestemte pulmonal AVM eller et unormalt kontrastekokardiogram uten tydelig synlige lesjoner anses å være utsatt for hjerneemboli. De rådes derfor til å unngå dykking , hvor små luftbobler kan dannes i blodet som kan migrere til hjernen og forårsake hjerneslag. På samme måte anbefales antimikrobiell profylakse under prosedyrer der bakterier kan komme inn i blodet, for eksempel tannarbeid , og unngå luftbobler under intravenøs behandling .
Lever AVM
Gitt at lever-AVM generelt forårsaker hjertesvikt med høy effekt, er det lagt vekt på å behandle dette med diuretika for å redusere sirkulerende blodvolum, begrensning av salt- og væskeinntak og antiarytmiske midler ved uregelmessig hjerterytme . Dette kan være tilstrekkelig for behandling av symptomer på hevelse og andpustenhet. Hvis denne behandlingen ikke er effektiv eller fører til bivirkninger eller komplikasjoner, er det eneste gjenværende alternativet levertransplantasjon . Dette er forbeholdt de med alvorlige symptomer, da det bærer en dødelighet på omtrent 10%, men fører til gode resultater hvis det lykkes. Det eksakte punktet hvor levertransplantasjon skal tilbys er ennå ikke helt fastslått. Emboliseringsbehandling er forsøkt, men fører til alvorlige komplikasjoner hos en andel pasienter og frarådes.
Andre leverrelaterte komplikasjoner (portalhypertensjon, esophageal varices, ascites, hepatisk encefalopati) behandles med de samme metodene som brukes ved skrumplever , selv om bruk av transjugulær intrahepatisk portosystemisk shuntbehandling frarådes på grunn av mangel på dokumentert fordel.
Hjerne AVM
Beslutningen om å behandle arteriovenøse misdannelser i hjernen avhenger av symptomene de forårsaker (for eksempel anfall eller hodepine). Blødningsrisikoen forutsies av tidligere episoder med blødning, og enten det er ved CTA- eller MRA- skanning, ser AVM ut til å være dyp eller ha dyp venøs drenering. Størrelsen på AVM og tilstedeværelsen av aneurismer ser ut til å ha mindre betydning. I HHT har noen lesjoner (arteriovenøse fistler med høy strømning) en tendens til å forårsake flere problemer, og behandling er berettiget. Andre AVM -er kan gå tilbake over tid uten intervensjon. Ulike metoder er tilgjengelige, avhengig av plasseringen av AVM og størrelsen: kirurgi, strålingsbasert behandling og embolisering. Noen ganger brukes flere metoder på samme lesjon.
Kirurgi (ved kraniotomi , åpen hjernekirurgi) kan tilbys basert på risikoen ved behandling som er bestemt av Spetzler – Martin -skalaen (grad IV); denne poengsummen er høyere i større lesjoner som er nær viktige hjernestrukturer og har dyp venøs drenering. Lesjoner av høy grad (IV og V) har en uakseptabelt høy risiko, og kirurgi tilbys vanligvis ikke i slike tilfeller. Radiokirurgi (ved hjelp av målrettet strålebehandling, for eksempel med en gammakniv ) kan brukes hvis lesjonen er liten, men nær vitale strukturer. Til slutt kan embolisering brukes på små lesjoner som bare har et enkelt fôrkar.
Eksperimentelle behandlinger
Flere legemidler mot angiogenese som er godkjent for andre tilstander, for eksempel kreft, har blitt undersøkt i små kliniske studier. For eksempel har anti- VEGF- antistoffet bevacizumab blitt brukt off-label i flere studier. I en stor klinisk studie var infusjon av bevacizumab assosiert med en reduksjon i hjerteeffekten og redusert varighet og antall episoder med epistaxis hos behandlede HHT -pasienter. Det ble også rapportert at Thalidomide , et annet legemiddel mot angiogenese , har gunstige effekter hos HHT-pasienter. Thalidomidbehandling ble funnet å indusere karmodning i en eksperimentell musemodell av HHT og redusere alvorlighetsgraden og hyppigheten av neseblod hos flertallet av en liten gruppe HHT -pasienter. Blodhemoglobinnivået til disse behandlede pasientene økte som et resultat av redusert blødning og forbedret blodkarstabilisering.
Epidemiologi

Befolkningsstudier fra mange områder i verden har vist at HHT forekommer omtrent i samme hastighet i nesten alle populasjoner: et sted rundt 1 av 5000. I noen områder er det mye mer vanlig; for eksempel i den franske regionen Haut Jura er prisen 1: 2351 - dobbelt så vanlig som i andre populasjoner. Dette har blitt tilskrevet en grunnleggereffekt , der en befolkning som stammer fra et lite antall forfedre har en høy grad av et bestemt genetisk trekk fordi en av disse forfedrene hadde denne egenskapen. I Haut Jura har dette vist seg å være et resultat av en bestemt ACVRL1 -mutasjon (kalt c.1112dupG eller c.1112_1113insG). Den høyeste frekvensen av HHT er 1: 1331, rapportert i Bonaire og Curaçao , to øyer i Karibia som tilhører De nederlandske Antillene .
De fleste mennesker med HHT har en normal levetid. Hudskader og neseblod har en tendens til å utvikle seg i barndommen. AVM er sannsynligvis tilstede fra fødselen, men forårsaker ikke nødvendigvis noen symptomer. Hyppig neseblod er det vanligste symptomet og kan påvirke livskvaliteten betydelig .
Historie
Flere engelske leger fra 1800 -tallet, som begynte med Henry Gawen Sutton (1836–1891) og etterfulgt av Benjamin Guy Babington (1794–1866) og John Wickham Legg (1843–1921), beskrev de vanligste trekkene ved HHT, spesielt tilbakevendende neseblod og sykdommens arvelige natur. Den franske legen Henri Jules Louis Marie Rendu (1844–1902) observerte hud- og slimhinneskader, og skilte tilstanden fra hemofili . Den kanadiskfødte Sir William Osler (1849–1919), deretter ved Johns Hopkins Hospital og senere ved Oxford University , ga ytterligere bidrag med en rapport fra 1901 der han beskrev karakteristiske lesjoner i fordøyelseskanalen . Den engelske legen Frederick Parkes Weber (1863–1962) rapporterte videre om tilstanden i 1907 med en rekke tilfeller. Begrepet "arvelig hemorragisk telangiectasia" ble først brukt av den amerikanske legen Frederic M. Hanes (1883–1946) i en artikkel fra 1909 om tilstanden.
Diagnosen HHT forble klinisk inntil de genetiske defektene som forårsaker HHT ble identifisert av en forskergruppe ved Duke University Medical Center , henholdsvis i 1994 og 1996. I 2000 publiserte den internasjonale vitenskapelige rådgivende komiteen til HHT Foundation International de nå mye brukte Curaçao -kriteriene. I 2006 møttes en gruppe internasjonale eksperter i Canada og formulerte en bevisbasert retningslinje , sponset av HHT Foundation International.
Referanser
| Klassifisering | |
|---|---|
| Eksterne ressurser |