Livmorkreft - Endometrial cancer
| Livmorkreft | |
|---|---|
| Andre navn | Livmorkreft |
 | |
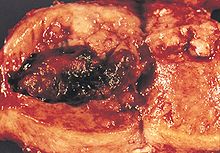
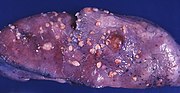
| Plassering og utvikling av endometrial kreft. | |
| Spesialitet | Onkologi , gynekologi |
| Symptomer | Vaginal blødning , smerter ved vannlating eller samleie , bekkenpine |
| Vanlig start | Etter overgangsalderen |
| Risikofaktorer | Fedme , overdreven østrogeneksponering , høyt blodtrykk , diabetes , familiehistorie |
| Diagnostisk metode | Endometrial biopsi |
| Behandling | Abdominal hysterektomi , strålebehandling , cellegift , hormonbehandling |
| Prognose | Fem års overlevelse ~ 80% (USA) |
| Frekvens | 3,8 millioner (totalt påvirket i 2015) |
| Dødsfall | 89 900 (2015) |
Endometrial kreft er en kreft som oppstår fra endometrium ( slimhinnen i livmoren eller livmoren). Det er resultatet av unormal vekst av celler som har evnen til å invadere eller spre seg til andre deler av kroppen. Det første tegnet er oftest vaginal blødning som ikke er forbundet med menstruasjon . Andre symptomer inkluderer smerter ved vannlating , smerter under samleie eller smerter i bekkenet . Endometrial kreft forekommer oftest etter overgangsalderen .
Omtrent 40% av tilfellene er relatert til fedme . Endometrial kreft er også forbundet med overdreven østrogeneksponering , høyt blodtrykk og diabetes . Mens det å ta østrogen alene øker risikoen for livmorkreft, reduserer risikoen for å ta både østrogen og et gestagen i kombinasjon, som med de fleste p -piller . Mellom to og fem prosent av tilfellene er relatert til gener som er arvet fra foreldrene. Endometrial kreft blir noen ganger løst referert til som " livmorkreft ", selv om den er forskjellig fra andre former for livmorkreft som livmorhalskreft , livmorsarkom og trofoblastisk sykdom . Den hyppigste typen av livmorkreft er endometrioid karsinom , som utgjør mer enn 80% av tilfellene. Endometrial kreft diagnostiseres vanligvis ved endometrial biopsi eller ved å ta prøver under en prosedyre kjent som utvidelse og curettage . Et pap -smøre er vanligvis ikke tilstrekkelig for å vise livmorhalskreft. Regelmessig screening hos personer med normal risiko er ikke nødvendig.
Det ledende behandlingsalternativet for endometriekreft er abdominal hysterektomi (total fjerning ved operasjon av livmoren), sammen med fjerning av egglederne og eggstokkene på begge sider, kalt en bilateral salpingo-oophorektomi . I mer avanserte tilfeller kan strålebehandling , cellegift eller hormonbehandling også anbefales. Hvis sykdommen blir diagnostisert på et tidlig stadium , er utfallet gunstig, og den totale femårige overlevelsesraten i USA er større enn 80%.
I 2012 oppstod endometrial kreft nylig hos 320 000 kvinner og forårsaket 76 000 dødsfall. Dette gjør den til den tredje vanligste dødsårsaken for kreft som bare rammer kvinner, bak eggstokkreft og livmorhalskreft. Det er mer vanlig i den utviklede verden og er den vanligste kreften i den kvinnelige reproduktive kanalen i utviklede land. Antall kreft i livmorhalsen har steget i en rekke land mellom 1980- og 2010. Dette antas å skyldes økende antall eldre og økende fedme.
Tegn og symptomer
Vaginal blødning eller flekker hos kvinner etter overgangsalderen forekommer i 90% av livmorkreft. Blødning er spesielt vanlig med adenokarsinom , som forekommer i to tredjedeler av alle tilfeller. Unormale menstruasjonssykluser eller ekstremt lange, tunge eller hyppige episoder med blødning hos kvinner før overgangsalderen kan også være et tegn på endometrial kreft.
Andre symptomer enn blødning er ikke vanlige. Andre symptomer inkluderer tynn hvit eller klar vaginal utslipp hos postmenopausale kvinner. Mer avansert sykdom viser mer åpenbare symptomer eller tegn som kan oppdages ved en fysisk undersøkelse . Livmoren kan bli forstørret eller kreften kan spre seg og forårsake smerter i underlivet eller kramper i bekkenet. Smertefullt samleie eller smertefull eller vanskelig vannlating er mindre vanlige tegn på endometrial kreft. Livmoren kan også fylle med pus ( pyometrea ). Av kvinner med disse mindre vanlige symptomene (vaginal utslipp, bekkenpine og pus) har 10–15% kreft.
Risikofaktorer
Risikofaktorer for endometrial kreft inkluderer fedme , diabetes mellitus , brystkreft , bruk av tamoxifen , aldri hatt barn , sen overgangsalder, høye nivåer av østrogen og økende alder. Innvandringsstudier (migrasjonsstudier), som undersøker endringen i kreftrisiko i populasjoner som beveger seg mellom land med forskjellige kreftfrekvenser, viser at det er en miljøkomponent i endometrial kreft. Disse miljømessige risikofaktorene er ikke godt karakterisert.
Hormoner
De fleste risikofaktorene for livmorkreft involverer høye nivåer av østrogener. Anslagsvis 40% av tilfellene antas å være relatert til fedme. Ved fedme øker overskuddet av fettvev omdannelsen av androstenedion til estron , et østrogen. Høyere nivåer av estron i blodet forårsaker mindre eller ingen eggløsning og utsetter endometrium for kontinuerlig høye nivåer av østrogener. Fedme fører også til at mindre østrogen fjernes fra blodet. Polycystisk ovariesyndrom (PCOS), som også forårsaker uregelmessig eller ingen eggløsning, er forbundet med høyere frekvenser av endometrial kreft av samme grunner som fedme. Spesielt fedme, type II diabetes og insulinresistens er risikofaktorer for type I endometrial kreft. Fedme øker risikoen for endometrial kreft med 300–400%.
Østrogenerstatningsterapi i overgangsalderen når den ikke er balansert (eller "motsatt") med gestagen er en annen risikofaktor. Høyere doser eller lengre perioder med østrogenbehandling har høyere risiko for livmorkreft. Kvinner med lavere vekt har større risiko for østrogen uten motstand. En lengre fruktbarhet - enten fra en tidlig første menstruasjon eller sen overgangsalder - er også en risikofaktor. Østrogen uten opposisjon øker individets risiko for endometriekreft med 2–10 ganger, avhengig av vekt og terapilengde. Hos transmenn som tar testosteron og ikke har hatt en hysterektomi, kan konvertering av testosteron til østrogen via androstenedion føre til en høyere risiko for endometrial kreft.
Genetikk
Genetiske lidelser kan også forårsake endometrial kreft. Generelt bidrar arvelige årsaker til 2–10% av tilfeller av endometrial kreft. Lynch syndrom , en autosomal dominerende genetisk lidelse som hovedsakelig forårsaker tykktarmskreft , forårsaker også endometrial kreft, spesielt før overgangsalderen. Kvinner med Lynch syndrom har en 40–60% risiko for å utvikle endometrial kreft, høyere enn risikoen for å utvikle tykktarms- eller tarmkreft. Eggstokkreft og livmorkreft utvikler seg samtidig hos 20% av mennesker. Endometrial kreft utvikler seg nesten alltid før tykktarmskreft, i gjennomsnitt 11 år før. Karsinogenese ved Lynch syndrom kommer fra en mutasjon i MLH1 eller MLH2 : gener som deltar i prosessen med mismatch -reparasjon , som gjør at en celle kan rette feil i DNA. Andre gener mutert i Lynch syndrom inkluderer MSH2 , MSH6 og PMS2 , som også er reparasjonsgener som ikke samsvarer. Kvinner med Lynch syndrom representerer 2-3% av tilfeller av endometrial kreft; noen kilder plasserer dette så høyt som 5%. Avhengig av genmutasjonen har kvinner med Lynch syndrom forskjellige risikoer for endometrial kreft. Med MLH1 -mutasjoner er risikoen 54%; med MSH2, 21%; og med MSH6, 16%.
Kvinner med en familiehistorie av livmorkreft har høyere risiko. To gener som oftest er assosiert med noen andre kvinnekreftformer, BRCA1 og BRCA2 , forårsaker ikke endometrial kreft. Det er en tilsynelatende kobling med disse genene, men det kan tilskrives bruk av tamoxifen, et stoff som i seg selv kan forårsake endometrial kreft, i bryst- og eggstokkreft. Den arvelige genetiske tilstanden Cowden syndrom kan også forårsake endometrial kreft. Kvinner med denne lidelsen har en risiko på 5–10% i livstid for å utvikle endometrial kreft, sammenlignet med 2–3% risiko for upåvirkede kvinner.
Vanlig genetisk variasjon har også vist seg å påvirke risiko for livmorkreft i livmorhalsen i store genomeomfattende assosiasjonsstudier . Seksten genomiske regioner har vært assosiert med endometrial kreft, og de vanlige variantene forklarer opptil 7% av familiens relative risiko.
Andre helseproblemer
Noen behandlinger for andre former for kreft øker livstidsrisikoen for livmorkreft, som er en basislinje på 2–3%. Tamoxifen, et legemiddel som brukes til å behandle østrogenpositiv brystkreft , har vært assosiert med endometrial kreft hos omtrent 0,1% av brukerne, spesielt eldre kvinner, men fordelene med å overleve fra tamoxifen oppveier generelt risikoen for endometrial kreft. Et til to-årig behandling med tamoxifen dobler omtrent risikoen for endometrial kreft, og et femårig behandlingsforløp firedobler denne risikoen. Raloxifene , et lignende legemiddel, økte ikke risikoen for endometrial kreft. Tidligere å ha eggstokkreft er en risikofaktor for endometrial kreft, som å ha hatt tidligere strålebehandling i bekkenet. Spesielt er ovarial granulosa celletumorer og thecomas svulster assosiert med endometrial kreft.
Lav immunfunksjon har også vært implisert i endometrial kreft. Høyt blodtrykk er også en risikofaktor, men dette kan skyldes at det er forbundet med fedme. Å sitte regelmessig i lengre perioder er forbundet med høyere dødelighet av endometrial kreft. Risikoen negeres ikke ved vanlig trening, selv om den senkes.
Beskyttelsesfaktorer
Røyking og bruk av gestagen er begge beskyttende mot endometrial kreft. Røyking gir beskyttelse ved å endre metabolismen av østrogen og fremme vekttap og tidlig overgangsalder. Denne beskyttende effekten varer lenge etter røykeslutt. Progestin er tilstede i den kombinerte orale prevensjonspillen og den hormonelle intrauterine enheten (IUD). Kombinert p -piller reduserer risikoen mer jo lenger de blir tatt: med 56% etter fire år, 67% etter åtte år og 72% etter tolv år. Denne risikoreduksjonen fortsetter i minst femten år etter at bruk av prevensjon er stoppet. Overvektige kvinner kan trenge høyere doser progestin for å beskyttes. Å ha hatt mer enn fem spedbarn (grand multiparity) er også en beskyttende faktor, og å ha minst ett barn reduserer risikoen med 35%. Amming i mer enn 18 måneder reduserer risikoen med 23%. Økt fysisk aktivitet reduserer individets risiko med 38–46%. Det er foreløpige bevis for at forbruk av soya er beskyttende.
Patofysiologi
|
Endometrial kreft dannes når det er feil i normal endometrial cellevekst . Vanligvis, når celler blir gamle eller blir skadet, dør de , og nye celler tar deres plass. Kreft starter når nye celler dannes unødvendige, og gamle eller skadede celler dør ikke som de skal. Oppbyggingen av ekstra celler danner ofte en vevsmasse som kalles en vekst eller svulst. Disse unormale kreftcellene har mange genetiske abnormiteter som får dem til å vokse for mye.
I 10–20% av endometriekreft, hovedsakelig grad 3 (den høyeste histologiske graden ), finnes mutasjoner i et tumorsuppressorgen , vanligvis p53 eller PTEN . I 20% av endometriehyperplasier og 50% av endometrioidkreftformer lider PTEN av funksjonshemmede mutasjoner eller en nullmutasjon , noe som gjør den mindre effektiv eller helt ineffektiv. Tap av PTEN-funksjon fører til oppregulering av PI3k/Akt/mTOR-banen, som forårsaker cellevekst. P53 -banen kan enten være undertrykt eller sterkt aktivert ved livmorkreft. Når en mutant versjon av p53 er overuttrykt, har kreften en tendens til å være spesielt aggressiv. P53 -mutasjoner og kromosominstabilitet er forbundet med serøse karsinomer, som har en tendens til å ligne eggstokkreft og egglederkarsinom. Serøse karsinomer antas å utvikle seg fra endometrial intraepitelial karsinom .
PTEN og p27 tap av funksjonsmutasjoner er forbundet med en god prognose, spesielt hos overvektige kvinner. Den Her2 / neu onkogenet , noe som indikerer en dårlig prognose, er uttrykt i 20% av endometrioid og serøs karsinomer. CTNNB1 (beta-catenin; et transkripsjonsgen ) mutasjoner finnes i 14–44% av endometrial kreft og kan indikere en god prognose, men dataene er uklare. Betakateninmutasjoner finnes ofte i livmorkreft med plateepitelceller . FGFR2 -mutasjoner finnes i omtrent 10% av endometrial kreft, og deres prognostiske betydning er uklar. SPOP er et annet svulstundertrykkende gen som er funnet å være mutert i noen tilfeller av endometrial kreft: 9% av klare celle endometrial karsinomer og 8% av serøse endometrial karsinomer har mutasjoner i dette genet.
Kreft av type I og type II (forklart nedenfor) har en tendens til å ha forskjellige mutasjoner involvert. ARID1A, som ofte bærer en punktmutasjon i type I endometrial kreft, er også mutert i 26% av klare cellekarsinomer i endometrium og 18% av serøse karsinomer. Epigenetisk demping og punktmutasjoner av flere gener er vanligvis funnet i type I endometrial kreft. Mutasjoner i tumorundertrykkende gener er vanlige ved type II endometrial kreft. PIK3CA er vanligvis mutert i både type I og type II kreft. Hos kvinner med Lynch syndrom-assosiert endometrial kreft er mikrosatellitt ustabilitet vanlig.
Utvikling av endometrial hyperplasi (overvekst av endometrialceller) er en betydelig risikofaktor fordi hyperplasi kan og ofte utvikler seg til adenokarsinom, selv om kreft kan utvikle seg uten tilstedeværelse av hyperplasi. I løpet av ti år utvikler 8–30% av atypiske endometriehyperplasier seg til kreft, mens 1-3% av ikke-atypiske hyperplasier gjør det. En atypisk hyperplasi er en med synlige abnormiteter i kjernene . Pre-kreft endometrial hyperplasi kalles også endometrial intraepitelial neoplasi . Mutasjoner i KRAS -genet kan forårsake endometrial hyperplasi og derfor type I endometrial kreft. Endometrial hyperplasi oppstår vanligvis etter fylte 40 år. Endometrial glandulær dysplasi oppstår med en overuttrykk av p53, og utvikler seg til et serøst karsinom.
Diagnose
Diagnosen kreft i livmorhalsen stilles først ved en fysisk undersøkelse, endometriebiopsi, eller utvidelse og curettage (fjerning av endometriumvev; D&C). Dette vevet undersøkes deretter histologisk for egenskaper ved kreft. Hvis det oppdages kreft, kan medisinsk bildebehandling gjøres for å se om kreften har spredt seg eller invadert vev.
Undersøkelse
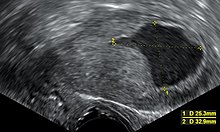
Rutinemessig screening av asymptomatiske mennesker er ikke indisert siden sykdommen er sterkt helbredelig i de tidlige symptomatiske stadiene. I stedet bør kvinner, spesielt kvinner i overgangsalderen, være oppmerksom på symptomene og risikofaktorene ved endometrial kreft. En cervikal screeningtest , for eksempel en Pap -smear , er ikke et nyttig diagnostisk verktøy for endometrial kreft fordi utstrykingen vil være normal 50% av tiden. Et Pap -smøre kan oppdage sykdom som har spredt seg til livmorhalsen. Resultater fra en bekkenundersøkelse er ofte normale, spesielt i de tidlige stadiene av sykdommen. Endringer i livmorens størrelse, form eller konsistens eller dens omgivende, støttende strukturer kan eksistere når sykdommen er mer avansert. Cervikal stenose , innsnevring av livmorhalsåpningen, er et tegn på endometrial kreft når pus eller blod blir funnet samlet i livmoren (pyometra eller hematometra ).
Kvinner med Lynch syndrom bør begynne å ha årlig biopsiscreening i en alder av 35 år. Noen kvinner med Lynch syndrom velger å ha profylaktisk hysterektomi og salpingo-oophorektomi for å redusere risikoen for endometrial og eggstokkreft kraftig.
Transvaginal ultralyd for å undersøke endometrietykkelsen hos kvinner med postmenopausal blødning brukes i økende grad for å hjelpe til med diagnosen endometrial kreft i USA. I Storbritannia er både en endometrial biopsi og en transvaginal ultralyd som brukes sammen, standard for behandling av endometrial kreft. Homogeniteten til vevet som er synlig på transvaginal ultralyd kan bidra til å indikere om tykkelsen er kreft. Ultralydfunn alene er ikke avgjørende i tilfeller av endometrial kreft, så en annen screeningmetode (for eksempel endometrial biopsi) må brukes sammen. Andre bildestudier har begrenset bruk. CT-skanninger brukes til preoperativ avbildning av svulster som ser avanserte ut ved fysisk undersøkelse eller har en høyrisikotype (med høy risiko for metastase ). De kan også brukes til å undersøke ekstrapelvic sykdom. En MR kan være til nytte for å avgjøre om kreften har spredt seg til livmorhalsen eller om det er et endocervikal adenokarsinom. MR er også nyttig for å undersøke lymfeknuter i nærheten.
Dilatasjon og curettage eller endometrial biopsi brukes for å få en vevsprøve for histologisk undersøkelse. Endometrial biopsi er det mindre invasive alternativet, men det gir kanskje ikke avgjørende resultater hver gang. Hysteroskopi viser bare grov anatomi av endometrium, som ofte ikke er tegn på kreft, og derfor ikke brukes, med mindre det er i forbindelse med en biopsi. Hysteroskopi kan brukes til å bekrefte en kreftdiagnose. Nye bevis viser at D&C har en høyere falsk negativ rate enn endometriebiopsi.
Før behandling påbegynnes, anbefales flere andre undersøkelser. Disse inkluderer røntgenstråler, leverfunksjonstester , nyrefunksjonstester og en test for nivåer av CA-125 , en svulstmarkør som kan forhøyes ved livmorkreft.
Klassifisering
Endometrial kreft kan være svulster avledet fra epitelceller (karsinomer), blandede epitel- og mesenkymale svulster (karsinosarkomer) eller mesenkymale svulster.
Tradisjonell klassifisering av endometriumkarsinomer er enten basert på kliniske og endokrine trekk (type I og type II) eller histopatologiske egenskaper (endometrioid, serøs og klarcellet). Noen svulster er vanskelige å klassifisere og har funksjoner som overlapper mer enn én kategori. Spesielt endometrioide svulster av høy kvalitet har en tendens til å ha både type I og type II -funksjoner.
Karsinom
De aller fleste endometriecancer er karsinomer (vanligvis adenokarsinomer), noe som betyr at de stammer fra det eneste laget av epitelceller som strekker seg i endometrium og danner endometriumkjertlene. Det er mange mikroskopiske undertyper av endometriumkarsinom, men de er stort sett organisert i to kategorier, type I og type II, basert på kliniske trekk og patogenese. De to undertyper er genetisk forskjellige.
Type I endometrial karsinom forekommer oftest før og rundt tidspunktet for overgangsalderen. I USA er de mer vanlige hos hvite kvinner , spesielt de med en historie med endometrial hyperplasi. Type I endometrial kreft er ofte lavgradig, minimalt invasiv inn i den underliggende livmorveggen ( myometrium ), østrogenavhengig, og har et godt utfall med behandling. Type I -karsinomer representerer 75–90% av livmorkreft.
Type II endometrial karsinom forekommer vanligvis hos eldre, postmenopausale mennesker, i USA er mer vanlig hos svarte kvinner , og er ikke forbundet med økt eksponering for østrogen eller en historie med endometrial hyperplasi. Type II endometrial kreft er ofte av høy kvalitet, med dyp invasjon i den underliggende livmorveggen (myometrium), er av serøs eller klar celletype og har en dårligere prognose. De kan se ut til å være epitelial eggstokkreft ved vurdering av symptomer. De har en tendens til å presentere senere enn type I -svulster og er mer aggressive, med større risiko for tilbakefall og/eller metastase.
Endometrioid adenokarsinom
Ved endometrioid adenokarsinom vokser kreftcellene i mønstre som minner om normalt endometrium, med mange nye kjertler dannet av søyleepitel med noen unormale kjerner . Lavgradige endometrioide adenokarsinomer har godt differensierte celler, har ikke invadert myometrium og ses ved siden av endometrial hyperplasi. Svulstens kjertler dannes veldig tett sammen, uten stromavævet som normalt skiller dem. Endometrioide adenokarsinomer av høyere kvalitet har mindre godt differensierte celler, har flere solide ark av tumorceller som ikke lenger er organisert i kjertler og er assosiert med et atrofiert endometrium. Det er flere undertyper av endometrioid adenokarsinom med lignende prognoser, inkludert villoglandulære, sekretoriske og cilierte cellevarianter. Det er også en undertype preget av plateepitel differensiering. Noen endometrioide adenokarsinomer har fokus på mucinøst karsinom.
De genetiske mutasjonene som oftest er assosiert med endometrioid adenokarsinom er i genene PTEN, en svulstundertrykkende; PIK3CA, en kinase ; KRAS, en GTPase som fungerer i signaltransduksjon ; og CTNNB1, involvert i vedheft og cellesignalering. CTNNB1 (beta-catenin) genet er oftest mutert i den plateepitelige undertypen av endometrioid adenokarsinom.
Alvorlig karsinom
Serøst karsinom er en type II endometrial svulst som utgjør 5-10% av diagnostisert endometrial kreft og er vanlig hos postmenopausale kvinner med atrofied endometrium og svarte kvinner. Serøst endometriumkarsinom er aggressivt og invaderer ofte myometrium og metastaserer i bukhinnen (sett på som omental caking ) eller lymfesystemet. Histologisk ser det ut med mange atypiske kjerner, papillære strukturer og, i motsetning til endometrioide adenokarsinomer, avrundede celler i stedet for søyle celler. Omtrent 30% av endometrial serøse karsinomer har også psammomlegemer . Serøse karsinomer sprer seg annerledes enn de fleste andre livmorkreft; de kan spre seg utenfor livmoren uten å invadere myometrium.
De genetiske mutasjonene som ses ved serøst karsinom er kromosomal ustabilitet og mutasjoner i TP53 , et viktig tumorundertrykkende gen.
Klarcellet karsinom
Klarcellet karsinom er en type II endometrial svulst som utgjør mindre enn 5% av diagnostisert endometrial kreft. Som serøs cellekarsinom er det vanligvis aggressivt og har en dårlig prognose. Histologisk er det preget av funksjonene som er felles for alle klare celler : den selvtitulerte klare cytoplasma når H&E farget og synlige, forskjellige cellemembraner. P53 -cellesignalsystemet er ikke aktivt i endometrial clear cell carcinoma. Denne formen for livmorkreft er mer vanlig hos postmenopausale kvinner.
Mucinøst karsinom
Mucinøse karsinomer er en sjelden form for endometrial kreft, og utgjør mindre enn 1-2% av all diagnostisert endometrial kreft. Mucinøse endometriske karsinomer er oftest stadium I og klasse I, noe som gir dem en god prognose. De har vanligvis godt differensierte kolonneceller organisert i kjertler med det karakteristiske mucinet i cytoplasma. Mucinøse karsinomer må differensieres fra cervikal adenokarsinom .
Blandet eller udifferensiert karsinom
Blandede karsinomer er de som har både type I og type II celler, med en som utgjør minst 10% av svulsten. Disse inkluderer den ondartede blandede Müllerian -svulsten , som stammer fra endometrial epitel og har en dårlig prognose.
Udifferensierte endometriekarsinomer utgjør mindre enn 1-2% av diagnostiserte endometriecancer. De har en dårligere prognose enn svulster i klasse III. Histologisk viser disse svulstene ark av identiske epitelceller uten noe identifiserbart mønster.
Andre karsinomer
Ikke-metastatisk plateepitelkarsinom og overgangscellekarsinom er svært sjeldne i endometrium. Squamous cell carcinoma of endometrium har en dårlig prognose. Det har blitt rapportert færre enn 100 ganger i medisinsk litteratur siden karakteriseringen i 1892. For at primær plateepitelkarsinom i endometriet (PSCCE) skal bli diagnostisert, må det ikke være annen primær kreft i endometrium eller livmorhalsen, og det må ikke være koblet til livmorhalsepitelet. På grunn av sjeldenheten til denne kreften, er det ingen retningslinjer for hvordan den skal behandles, og heller ikke noen typisk behandling. De vanlige genetiske årsakene forblir ukarakteriserte. Primære overgangscellekarsinomer i endometrium er enda mer sjeldne; 16 tilfeller hadde blitt rapportert fra og med 2008. Dens patofysiologi og behandlinger har ikke blitt karakterisert. Histologisk ligner TCCE endometrioidkarsinom og er forskjellig fra andre overgangscellekarsinomer.
Sarkom
I motsetning til endometrial karsinom, uvanlige endometriale stroma- sarkomer er kreft som har opphav i den ikke-kjertel bindevev av endometrium. De er generelt ikke-aggressive og kan ta flere tiår hvis de gjentar seg. Metastaser i lungene og bekken- eller bukhulen er de hyppigste. De har vanligvis østrogen- og/eller progesteronreseptorer. Prognosen for lavgradig endometrial stromal sarkom er god, med 60–90% fem års overlevelse. Høykvalitets udifferensiert endometrial sarkom (HGUS) har en dårligere prognose, med høy tilbakefall og 25% femårig overlevelse. HGUS -prognosen er diktert av om kreften har invadert arteriene og venene eller ikke. Uten vaskulær invasjon er den femårige overlevelsen 83%; den synker til 17% når vaskulær invasjon blir observert. Fase I ESS har den beste prognosen, med fem års overlevelse på 98% og ti års overlevelse på 89%. ESS utgjør 0,2% av livmorkreft.
Metastase
Endometrial kreft metastaserer ofte til eggstokkene og egglederne når kreften befinner seg i den øvre delen av livmoren, og livmorhalsen når kreften er i den nedre delen av livmoren. Kreften sprer seg vanligvis først inn i myometrium og serosa , deretter til andre reproduktive og bekkenstrukturer. Når lymfesystemet er involvert, er bekken- og para-aortaknuter vanligvis først involvert, men i ikke noe spesifikt mønster, i motsetning til livmorhalskreft. Mer fjerne metastaser spres av blodet og forekommer ofte i lungene, så vel som leveren, hjernen og beinet. Endometrial kreft metastaserer i lungene 20–25% av tiden, mer enn noen annen gynekologisk kreft.
Histopatologi
Det er et trelags system for histologisk klassifisering av endometrial kreft, alt fra kreft med godt differensierte celler (grad I), til svært dårlig differensierte celler (grad III). Grad I -kreft er minst aggressiv og har den beste prognosen, mens svulster i grad III er de mest aggressive og sannsynligvis vil gjenta seg. Grad II -kreftformer er mellomliggende mellom klasse I og III når det gjelder celledifferensiering og aggressivitet av sykdom.
Histopatologien til endometriekreft er svært variert. Det vanligste funnet er et godt differensiert endometrioid adenokarsinom, som består av mange, små, overfylte kjertler med varierende grad av nukleær atypi, mitotisk aktivitet og stratifisering. Dette vises ofte på bakgrunn av endometrial hyperplasi. Frank adenokarsinom kan skilles fra atypisk hyperplasi ved å finne tydelig stromal invasjon, eller "back-to-back" kjertler som representerer ikke-ødeleggende erstatning av endometrial stroma av kreften. Med progresjonen av sykdommen infiltreres myometrium.
Iscenesettelse
Endometrial karsinom iscenesatt kirurgisk ved bruk av FIGO kreft -iscenesettingssystem . FIGO -oppsettingssystemet 2009 er som følger:
| Scene | Beskrivelse |
|---|---|
| IA | Svulst er begrenset til livmoren med mindre enn halv myometrial invasjon |
| IB | Svulst er begrenset til livmoren med mer enn halv myometrial invasjon |
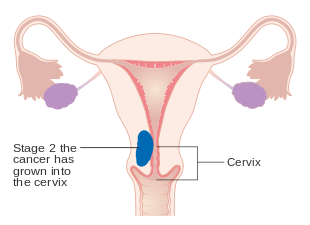
| II | Tumor involverer livmoren og livmorhalsen stroma |
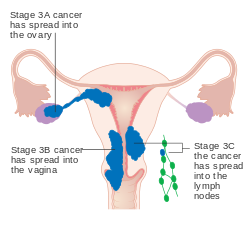
| IIIA | Svulst invaderer serosa eller adnexa |
| IIIB | Vaginal og/eller parametrisk involvering |
| IIIC1 | Bekymring av bekkenlymfeknuter |
| IIIC2 | Para-aorta lymfeknute-involvering, med eller uten bekkenknuteangrep |
| IVA | Svulst invaderer blæreslimhinnen og/eller tarmslimhinnen |
| IVB | Fjernmetastaser inkludert abdominale metastaser og/eller inguinale lymfeknuter |
Myometrial invasjon og involvering av bekken- og para-aorta lymfeknuter er de vanligste spredningsmønstrene. Noen ganger er et trinn 0 inkludert, i dette tilfellet blir det referert til som " karsinom in situ ". I 26% av kreftene antagelig på et tidlig stadium avslørte intraoperativ iscenesetting bekken- og fjerne metastaser, noe som gjorde omfattende kirurgisk iscenesettelse nødvendig.
Ledelse
Kirurgi
Den første behandlingen for endometrial kreft er kirurgi; 90% av kvinnene med endometrial kreft behandles med en eller annen form for kirurgi. Kirurgisk behandling består vanligvis av hysterektomi inkludert en bilateral salpingo-oophorektomi , som er fjerning av livmoren, og både eggstokkene og egglederne. Lymfadenektomi , eller fjerning av bekken- og para-aorta lymfeknuter , utføres for svulster av histologisk grad II eller høyere. Lymfadenektomi utføres rutinemessig for alle stadier av endometrial kreft i USA, men i Storbritannia blir lymfeknuter vanligvis bare fjernet med sykdom i stadium II eller høyere. Temaet lymfadenektomi og hvilken overlevelsesfordel det gir i fase I -sykdom, diskuteres fortsatt. Hos kvinner med antatt stadium I -sykdom, fant en systematisk gjennomgang fra 2017 ingen bevis for at lymfadenektomi reduserer risikoen for død eller tilbakefall av kreft sammenlignet med ingen lymfadenektomi. Kvinner som gjennomgår lymfadenektomi er mer sannsynlig å oppleve systemisk sykelighet knyttet til kirurgi eller lymfødem/lymfocystdannelse. I kreft i stadium III og IV er cytoreduktiv kirurgi normen, og en biopsi av omentum kan også inkluderes. I stadium IV sykdom, hvor det er fjerne metastaser, kan kirurgi brukes som en del av palliativ terapi. Laparotomi , en åpen mage-prosedyre, er den tradisjonelle kirurgiske prosedyren; Imidlertid er laparoskopi (nøkkelhullskirurgi) assosiert med redusert operativ sykelighet og lignende total og sykdomsfri overlevelse hos de med antatt tidlig stadium av primær endometrial kreft . Fjerning av livmoren via magen anbefales over fjerning av livmoren via skjeden fordi det gir mulighet til å undersøke og få vasker av bukhulen for å oppdage ytterligere tegn på kreft. Staging av kreften utføres under operasjonen.
De få kontraindikasjonene til kirurgi inkluderer inoperabel svulst, massiv fedme, en spesielt risikofylt operasjon eller et ønske om å bevare fruktbarheten. Disse kontraindikasjonene skjer i omtrent 5-10% av tilfellene. Kvinner som ønsker å bevare fruktbarheten og har kreft i stadium I av lav grad, kan behandles med gestagener, med eller uten samtidig behandling med tamoxifen. Denne terapien kan fortsette til kreften ikke reagerer på behandling eller til fødsel er utført. Uterin perforering kan forekomme under en D&C eller en endometrial biopsi. Bivirkninger av kirurgi for å fjerne endometrial kreft kan spesifikt inkludere seksuell dysfunksjon, midlertidig inkontinens og lymfødem , sammen med mer vanlige bivirkninger av enhver operasjon, inkludert forstoppelse .
Tilleggsterapi
Det finnes en rekke mulige tilleggsbehandlinger. Kirurgi kan etterfølges av strålebehandling og/eller cellegift i tilfeller av kreft med høy risiko eller høy grad. Dette kalles adjuvant terapi .
Kjemoterapi
Adjuvant kjemoterapi er en nylig innovasjon, som består av en kombinasjon av paklitaksel (eller andre taxaner som docetaxel ), doxorubicin (og andre antracykliner ) og platiner (spesielt cisplatin og karboplatin ). Adjuvant kjemoterapi har vist seg å øke overlevelsen i stadium III og IV kreft mer enn tilleggsstrålebehandling . Mutasjoner i mismatch -reparasjonsgener, som de som finnes i Lynch syndrom, kan føre til motstand mot platiner, noe som betyr at cellegift med platiner er ineffektiv hos mennesker med disse mutasjonene. Bivirkninger av cellegift er vanlige. Disse inkluderer hårtap , lave nøytrofile nivåer i blodet og gastrointestinale problemer.
I tilfeller der kirurgi ikke er indikert, er palliativ cellegift et alternativ; høyere dose cellegift er forbundet med lengre overlevelse. Palliativ cellegift, spesielt ved bruk av capecitabin og gemcitabin , brukes også ofte til å behandle tilbakevendende endometriekreft.
Bevis med lav sikkerhet tyder på at hos kvinner med tilbakevendende endometriekreft som har hatt cellegift, kan behandling med medisiner som hemmer mTOR -banen redusere risikoen for forverring av sykdom sammenlignet med mer cellegift eller hormonbehandling. Selv om mTOR -hemmere kan øke sjansen for å oppleve magesår.
Strålebehandling
Adjuvant strålebehandling brukes ofte i livmorkreft i tidlig fase (stadium I eller II). Det kan leveres gjennom vaginal brachyterapi (VBT), som blir den foretrukne ruten på grunn av redusert toksisitet, eller ekstern strålebehandling (EBRT). Brachyterapi innebærer å plassere en strålekilde i det berørte organet; ved endometrial kreft plasseres en strålingskilde direkte i skjeden. Strålebehandling ved ekstern stråle innebærer en stråle som er rettet mot det berørte området fra utsiden av kroppen. VBT brukes til å behandle gjenværende kreft utelukkende i skjeden, mens EBRT kan brukes til å behandle gjenværende kreft andre steder i bekkenet etter operasjonen. Fordelene med adjuvant strålebehandling er imidlertid kontroversielle. Selv om EBRT reduserer tilbakefallshastigheten i bekkenet betydelig, forbedres ikke total overlevelse og metastaser. VBT gir bedre livskvalitet enn EBRT.
Strålebehandling kan også brukes før kirurgi i visse tilfeller. Når preoperativ avbildning eller klinisk evaluering viser svulst som invaderer livmorhalsen, kan det gis stråling før en total hysterektomi utføres. Brachyterapi og EBRT kan også brukes, enkeltvis eller i kombinasjon, når det er kontraindikasjon for hysterektomi. Begge leveringsmetodene for strålebehandling er forbundet med bivirkninger, spesielt i mage -tarmkanalen .
Hormonell terapi
Hormonal terapi er bare gunstig ved visse typer endometrial kreft. Det ble en gang antatt å være gunstig i de fleste tilfeller. Hvis en svulst er godt differensiert og kjent for å ha progesteron- og østrogenreseptorer, kan progestiner brukes i behandlingen. Det er ingen holdepunkter for bruk av progestagen i tillegg til kirurgi for nydiagnostisert endometrial kreft. Omtrent 25% av metastatisk endometrioidkreft viser respons på progestiner. Endometrial stromale sarkomer kan også behandles med hormonelle midler, inkludert tamoxifen, hydroksyprogesteronkaproat , letrozol , megestrolacetat og medroksyprogesteron . Denne behandlingen er effektiv ved endometriale stromale sarkomer fordi de vanligvis har østrogen- og/eller progestinreseptorer . Progestinreseptorer fungerer som svulstundertrykkende midler i endometrial kreftceller. Foreløpig forskning og kliniske studier har vist at disse behandlingene har høy respons, selv ved metastatisk sykdom.
I 2010 har hormonbehandling uklar effekt hos de med avansert eller tilbakevendende endometriekreft. Det er utilstrekkelig bevis for å informere kvinner som vurderer hormonsubstitusjonsterapi etter behandling for livmorkreft.
Målrettet terapi
Dostarlimab er godkjent av FDA for behandling av endometrial kreft med spesifikk biomarkør
Overvåkning
Tumormarkøren CA-125 er ofte forhøyet ved endometrial kreft og kan brukes til å overvåke respons på behandling, spesielt ved serøs cellekreft eller avansert sykdom. Periodiske MR- eller CT -skanninger kan anbefales ved avansert sykdom, og kvinner med tidligere livmorkreft bør få hyppigere undersøkelser av bekkenet i fem år etter behandlingen. Undersøkelser som utføres hver tredje til fjerde måned anbefales de første to årene etter behandlingen, og hver sjette måned i de neste tre årene.
Kvinner med endometrial kreft bør ikke ha rutinemessig overvåking for å overvåke kreften med mindre nye symptomer dukker opp eller svulstmarkører begynner å stige. Avbildning uten disse indikasjonene frarådes fordi det er usannsynlig å oppdage gjentakelse eller forbedre overlevelse, og fordi det har sine egne kostnader og bivirkninger. Hvis det er mistanke om gjentakelse, anbefales PET/CT -skanning.
Prognose
Overlevelsesrater
| Scene | 5-års overlevelse |
|---|---|
| IA | 88% |
| IB | 75% |
| II | 69% |
| III-A | 58% |
| III-B | 50% |
| III-C | 47% |
| IV-A | 17% |
| IV-B | 15% |
Den femårige overlevelsesraten for endometrial adenokarsinom etter passende behandling er 80%. De fleste kvinner, over 70%, har FIGO stadium I kreft, som har den beste prognosen. Fase III og spesielt stadium IV -kreft har en dårligere prognose, men disse er relativt sjeldne og forekommer bare i 13% av tilfellene. Median overlevelsestid for stadium III - IV endometrial kreft er ni til ti måneder. Eldre alder indikerer en dårligere prognose. I USA har hvite kvinner en høyere overlevelsesrate enn svarte kvinner, som har en tendens til å utvikle mer aggressive former for sykdommen innen diagnosen. Svulster med høyt progesteronreseptoruttrykk har en god prognose sammenlignet med svulster med lavt progesteronreseptoruttrykk; 93% av kvinnene med høy progesteronreseptorsykdom overlevde til tre år, sammenlignet med 36% av kvinnene med lav progesteronreseptorsykdom. Hjertesykdom er den vanligste dødsårsaken blant dem som overlever livmorkreft, mens andre fedmerelaterte helseproblemer også er vanlige. Etter diagnosen er livskvalitet også positivt forbundet med en sunn livsstil (ingen fedme, kosthold av høy kvalitet, fysisk aktivitet).
Gjentakelsesrater
Gjentagelse av endometrial kreft i et tidlig stadium varierer fra 3 til 17%, avhengig av primær og adjuvant behandling. De fleste tilbakefall (75–80%) forekommer utenfor bekkenet, og de fleste forekommer innen to til tre års behandling - 64% innen to år og 87% innen tre år.
Det er mer sannsynlig at kreft med høyere trinn oppstår igjen, det samme er de som har invadert myometrium eller livmorhals, eller som har metastasert i lymfesystemet. Papillær serøs karsinom , klarcellet karsinom og endometrioidkarsinom er undertyper med størst risiko for tilbakefall. Histologiske subtyper av høy kvalitet har også en forhøyet risiko for tilbakefall.
Det vanligste stedet for tilbakefall er i skjeden ; vaginale tilbakefall av endometrial kreft har den beste prognosen. Hvis det oppstår tilbakefall fra kreft som ikke har blitt behandlet med stråling, er EBRT førstelinjebehandling og er ofte vellykket. Hvis en kreft behandlet med stråling gjentar seg, er bekkeneksenterasjon det eneste alternativet for kurativ behandling. Palliativ cellegift, cytoreduktiv kirurgi og stråling utføres også. Strålebehandling (VBT og EBRT) for lokal vaginal tilbakefall har 50% femårig overlevelse. Bekken -tilbakefall behandles med kirurgi og stråling, og abdominal tilbakefall behandles med stråling og, om mulig, cellegift. Andre vanlige tilbakefallssteder er bekkenlymfeknuter, para-aorta-lymfeknuter, bukhinnen (28%av tilbakefall) og lunger, selv om tilbakefall også kan forekomme i hjernen (<1%), lever (7%), binyrene ( 1%), bein (4–7%; vanligvis det aksiale skjelettet ), lymfeknuter utenfor magen (0,4–1%), milt og muskler/bløtvev (2–6%).
Epidemiologi
Fra 2014 blir omtrent 320 000 kvinner diagnostisert med endometrial kreft over hele verden hvert år og 76 000 dør, noe som gjør den til den sjette vanligste kreften hos kvinner. Det er mer vanlig i utviklede land, hvor livstidsrisikoen for livmorkreft hos kvinner er 1,6%, sammenlignet med 0,6% i utviklingsland. Det forekommer hos 12,9 av 100 000 kvinner årlig i utviklede land.
I USA er endometriekreft den hyppigst diagnostiserte gynekologiske kreften, og hos kvinner den fjerde vanligste kreften totalt sett, som representerer 6% av alle krefttilfeller hos kvinner. I det landet ble det fra 2014 anslått at 52.630 kvinner ble diagnostisert årlig og 8.590 ville dø av sykdommen. Nord -Europa, Øst -Europa og Nord -Amerika har de høyeste endometriekreftene, mens Afrika og Vest -Asia har de laveste. Asia så 41% av verdens endometrial kreftdiagnoser i 2012, mens Nord -Europa, Øst -Europa og Nord -Amerika til sammen utgjorde 48% av diagnosene. I motsetning til de fleste kreftformer har antallet nye tilfeller økt de siste årene, inkludert en økning på over 40% i Storbritannia mellom 1993 og 2013. Noe av denne økningen kan skyldes økningen i fedme i utviklede land, økt liv forventninger og lavere fødselsrate. Den gjennomsnittlige levetidsrisikoen for livmorkreft er cirka 2-3% hos mennesker med livmor. I Storbritannia blir det diagnostisert omtrent 7.400 tilfeller årlig, og i EU omtrent 88.000 tilfeller.
Endometrial kreft vises hyppigst i perimenopausen (perioden like før, like etter og i overgangsalderen), mellom 50 og 65 år; totalt sett oppstår 75% av endometrial kreft etter overgangsalderen. Kvinner yngre enn 40 utgjør 5% av tilfeller av endometrial kreft og 10–15% av tilfellene forekommer hos kvinner under 50 år. Denne aldersgruppen er i fare for å utvikle eggstokkreft samtidig. Den globale medianalderen for diagnosen er 63 år; i USA er gjennomsnittsalderen for diagnose 60 år. Hvite amerikanske kvinner har større risiko for livmorkreft enn svarte amerikanske kvinner, med henholdsvis 2,88% og 1,69% levetid. Japansk-amerikanske kvinner og amerikanske latinakvinner har lavere priser og innfødte hawaiiske kvinner har høyere priser.
Forskning
Det er flere eksperimentelle behandlinger for endometrial kreft under forskning, inkludert immunologiske, hormonelle og kjemoterapeutiske behandlinger. Trastuzumab (Herceptin), et antistoff mot Her2 -proteinet, har blitt brukt i kreftformer som er kjent for å være positive for Her2/neu -onkogenet, men forskning pågår fortsatt. Immunologiske behandlinger er også under etterforskning, spesielt ved livmor papillær serøs karsinom.
Kreft kan analyseres ved hjelp av genetiske teknikker (inkludert DNA -sekvensering og immunhistokjemi ) for å avgjøre om visse terapier som er spesifikke for muterte gener kan brukes til å behandle den. PARP -hemmere brukes til å behandle endometrial kreft med PTEN -mutasjoner, spesielt mutasjoner som senker uttrykket av PTEN. PARP -hemmeren som er vist å være aktiv mot endometrial kreft er olaparib . Forskning pågår på dette området fra 2010 -tallet.
Forskning pågår om bruk av metformin , en diabetesmedisin, hos overvektige kvinner med endometrial kreft før operasjonen. Tidlig forskning har vist at det er effektivt for å bremse frekvensen av kreftcelleproliferasjon. Foreløpig forskning har vist at administrasjon av metformin før operasjonen kan redusere uttrykk for tumormarkører. Langsiktig bruk av metformin har ikke vist seg å ha en forebyggende effekt mot kreftutvikling, men kan forbedre total overlevelse.
Temsirolimus , en mTOR -hemmer, er under utredning som en potensiell behandling. Forskning viser at mTOR -hemmere kan være spesielt effektive for kreft med mutasjoner i PTEN. Ridaforolimus (deforolimus) blir også forsket på som en behandling for personer som tidligere har hatt cellegift. Foreløpig forskning har vært lovende, og et stadium II -forsøk på ridaforolimus ble fullført innen 2013. Det har også vært forsket på kombinerte ridaforolimus/progestinbehandlinger for tilbakevendende endometrial kreft. Bevacizumab og tyrosinkinasehemmere , som hemmer angiogenese , blir undersøkt som potensielle behandlinger for endometriecancer med høye nivåer av vaskulær endotelial vekstfaktor . Ixabepilone blir undersøkt som en mulig cellegiftbehandling for avansert eller tilbakevendende endometrial kreft. Behandlinger for sjeldne udifferensierte endometrie sarkom av høy kvalitet blir undersøkt, siden det ikke er etablert noen standard for behandling av denne sykdommen. Kjemoterapier som undersøkes inkluderer doxorubicin og ifosfamid .
Det pågår også forskning på flere gener og biomarkører som kan være knyttet til endometrial kreft. Den beskyttende effekten av kombinerte orale prevensjonsmidler og lUD blir undersøkt. Foreløpig forskning har vist at levonorgestrel- lUD plassert i et år, kombinert med 6 månedlige injeksjoner av gonadotropinfrigivende hormon , kan stoppe eller reversere utviklingen av endometrial kreft hos unge kvinner; spesielt kompleks atypisk hyperplasi, men resultatene har vært ufattelige. Et eksperimentelt stoff som kombinerer et hormon med doxorubicin er også under etterforskning for større effekt ved kreft med hormonreseptorer. Hormonbehandling som er effektiv for behandling av brystkreft, inkludert bruk av aromatasehemmere , blir også undersøkt for bruk ved livmorkreft. Et slikt legemiddel er anastrozol , som for tiden forskes på hormonpositive tilbakefall etter cellegift. Forskning på hormonelle behandlinger for endometriale stromale sarkomer pågår også. Det inkluderer studier av legemidler som mifepriston , en progestinantagonist, og aminoglutetimid og letrozol, to aromatasehemmere.
Forskning fortsetter i den beste avbildningsmetoden for å oppdage og iscenesette endometrial kreft. Ved kirurgi har forskning vist at fullstendig bekkenlymfadenektomi sammen med hysterektomi i endometriekreft i stadium 1 ikke forbedrer overlevelse og øker risikoen for negative bivirkninger, inkludert lymfødem. Annen forskning undersøker potensialet for å identifisere vaktpostlymfeknuter for biopsi ved å injisere svulsten med fargestoff som skinner under infrarødt lys. Intensitetsmodulert strålebehandling er for tiden under etterforskning, og brukes allerede på noen sentre, for bruk i livmorkreft, for å redusere bivirkninger fra tradisjonell strålebehandling. Risikoen for gjentakelse er ennå ikke kvantifisert. Forskning på hyperbar oksygenbehandling for å redusere bivirkninger pågår også. Resultatene av PORTEC 3 -studien som vurderte kombinasjon av adjuvant strålebehandling med cellegift ble ventet i slutten av 2014.
Det er ikke nok bevis for å avgjøre om mennesker med livmorkreft drar nytte av ytterligere atferdsmessige og livsstilsintervensjoner som er rettet mot å miste vekt.
Historie og kultur
Endometrial kreft er ikke allment kjent av befolkningen, til tross for frekvensen. Det er lav bevissthet om symptomene, noe som kan føre til senere diagnose og dårligere overlevelse.
Referanser
Eksterne linker
| Klassifisering | |
|---|---|
| Eksterne ressurser |