Stasjonær tilstand - Stationary state
| Del av en artikkelserie om |
| Kvantemekanikk |
|---|
En stasjonær tilstand er en kvantetilstand med alle observerbare ting uavhengig av tid. Det er en egenvektor til energioperatøren (i stedet for en kvantesuperposisjon av forskjellige energier). Det kalles også energien egenvektor , energien egen tilstand , energiens egenfunksjon eller energien egenket . Det ligner veldig på begrepet atombane og molekylær orbital i kjemi, med noen små forskjeller forklart nedenfor .
Introduksjon
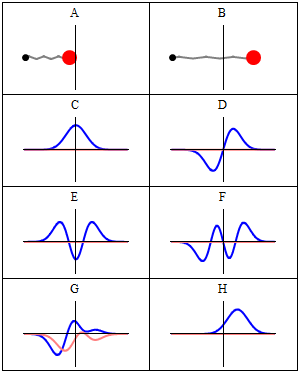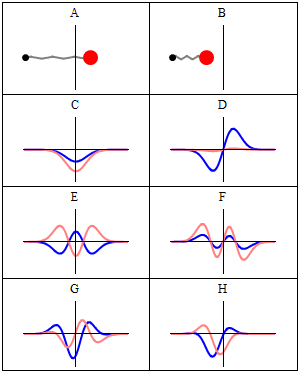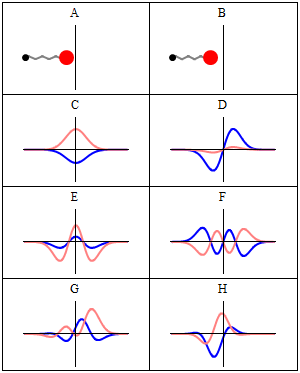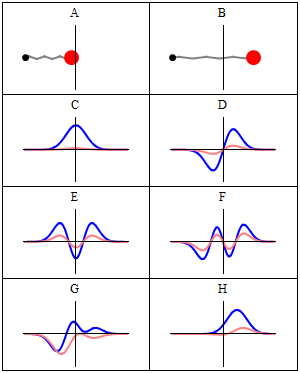
En stasjonær tilstand kalles stasjonær fordi systemet forblir i samme tilstand som tiden går, på alle observerbare måter. For en enkeltpartikkel Hamiltonian betyr dette at partikkelen har en konstant sannsynlighetsfordeling for sin posisjon, hastighet, spinn , etc. (Dette er sant forutsatt at partikkelen også er statisk, dvs. Hamiltonian er uendret i tid.) Selve bølgefunksjonen er ikke stasjonær: Den endrer kontinuerlig sin samlede komplekse fasefaktor for å danne en stående bølge . Oscillasjonsfrekvensen til den stående bølgen, ganger Plancks konstante , er statens energi i henhold til Planck - Einstein -forholdet .
Stasjonære tilstander er kvantetilstander som er løsninger på den tidsuavhengige Schrödinger-ligningen :
hvor
- er en kvantetilstand , som er en stasjonær tilstand hvis den tilfredsstiller denne ligningen;
- er den hamiltonske operatøren ;
- er et reelt tall , og tilsvarer tilstandens egenverdi .
Dette er en egenverdi -ligning : er en lineær operator på et vektorrom, er en egenvektor av , og er dens egenverdi.
Hvis en stasjonær tilstand er koblet til den tidsavhengige Schrödinger-ligningen , er resultatet:
Forutsatt at det er tidsuavhengig (uendret i tid), holder denne ligningen for enhver tid t . Derfor er dette en differensialligning som beskriver hvor varierende i tid. Løsningen er:
Derfor, er en stasjonær tilstand en stående bølge som oscillerer med en samlet kompleks fasefaktor , og dens svingning vinkelfrekvens er lik dens energi dividert med .
Stasjonære statlige eiendommer

Som vist ovenfor er en stasjonær tilstand ikke matematisk konstant:
Imidlertid er alle observerbare egenskaper til staten faktisk konstante i tid. For eksempel, hvis representerer en enkel endimensjonal enkeltpartikkelbølgefunksjon , er sannsynligheten for at partikkelen befinner seg på stedet x :
som er uavhengig av tiden t .
Den Heisen bilde er en alternativ matematisk formulering av kvantemekanikken hvor stasjonære tilstander virkelig er matematisk konstant over tid.
Som nevnt ovenfor antar disse ligningene at Hamiltonian er tidsuavhengig. Dette betyr ganske enkelt at stasjonære tilstander bare er stasjonære når resten av systemet er fast og også er stasjonært. For eksempel er et 1s -elektron i et hydrogenatom i en stasjonær tilstand, men hvis hydrogenatomet reagerer med et annet atom, vil elektronet selvfølgelig bli forstyrret.
Spontan forfall
Spontan forfall kompliserer spørsmålet om stasjonære stater. For eksempel, ifølge enkel ( ikke -relativistisk ) kvantemekanikk , har hydrogenatomet mange stasjonære tilstander: 1s, 2s, 2p , og så videre, er alle stasjonære tilstander. Men i virkeligheten er bare grunntilstanden 1s virkelig "stasjonær": Et elektron på et høyere energinivå vil spontant avgi en eller flere fotoner for å forfalle til grunntilstanden. Dette ser ut til å motsi ideen om at stasjonære stater skal ha uforanderlige egenskaper.
Forklaringen er at Hamiltonian brukt i ikke -relativistisk kvantemekanikk bare er en tilnærming til Hamiltonian fra kvantefeltteori . Elektronstatene med høyere energi (2s, 2p, 3s, etc.) er stasjonære tilstander i henhold til omtrentlige Hamiltonian, men ikke stasjonære i henhold til den sanne Hamiltonian, på grunn av vakuumfluktuasjoner . På den annen side er 1 -staten virkelig en stasjonær tilstand, i henhold til både den omtrentlige og den sanne hamiltoneren.
Sammenligning med "orbital" i kjemi
En orbital er en stasjonær tilstand (eller tilnærming derav) til et ett-elektronatom eller molekyl; nærmere bestemt en atombane for et elektron i et atom, eller en molekylær orbital for et elektron i et molekyl.
For et molekyl som bare inneholder et enkelt elektron (f.eks. Atomisk hydrogen eller H 2 + ), er en orbital nøyaktig den samme som en total stasjonær tilstand av molekylet. Imidlertid er en orbital for et mange-elektronmolekyl helt forskjellig fra en total stasjonær tilstand, som er en tilstand med mange partikler som krever en mer komplisert beskrivelse (for eksempel en Slater-determinant ). Spesielt i et mange-elektronmolekyl er en orbital ikke den totale stasjonære tilstanden til molekylet, men snarere den stasjonære tilstanden til et enkelt elektron i molekylet. Dette konseptet med en orbital er bare meningsfullt under tilnærmelsen til at hvis vi ignorerer elektron-elektron øyeblikkelig frastøtningsterminer i Hamiltonian som en forenkling av antagelse, kan vi dekomponere den totale egenvektoren til et mange-elektronmolekyl til separate bidrag fra individuelle elektronstasjonære tilstander (orbitaler), som hver oppnås under en-elektron-tilnærmingen. (Heldigvis kan kjemikere og fysikere ofte (men ikke alltid) bruke denne "tilnærmelsen til enkeltelektroner.") I denne forstand kan et orbital i et flerelektronsystem betraktes som den stasjonære tilstanden til et individuelt elektron i systemet .
I kjemi antar beregning av molekylære orbitaler vanligvis også Born -Oppenheimer -tilnærmingen .
Se også
Referanser
Videre lesning
- Stationære stater , Alan Holden, Oxford University Press, 1971, ISBN 0-19-851121-3












